
(1)CH3-CH3→CH2=CH2+H2,有关化学键的键能如下:
化学键 | C-H | C=C | C-C | H-H |
键能(kJ/mol) | 414.4 | 615.3 | 347.4 | 435.3 |
计算该反应的反应热 (写出计算过程)
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)= 2Fe(s)+3CO2(g) △H=-24.8kJ/mol
3Fe2O3(s)+ CO(g)=2Fe3O4(s)+CO2(g) △H=-47.2kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H=+640.5kJ/mol
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:
(3)发射卫星时可用肼(N2H4)为燃料,用二氧化氮为氧化剂,这两种物质反应生成氮气和水蒸气。
已知:N2(g)+2O2(g)===2NO2(g) ΔH1=+67.7 kJ/mol
N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH2=-534 kJ/mol
试计算1 mol肼和二氧化氮完全反应时放出的热量为__________________kJ,写出肼与二氧化氮反应的热化学方程式:______________________
科目:高中化学 来源:2015-2016学年吉林省高一上期中测试化学试卷(解析版) 题型:选择题
相等物质的量的H2O和H2O2相比较,下列有关叙述中正确的是
①它们所含的分子数目之比为1∶1
②它们所含的原子总数目之比为3∶4
③它们所含的O原子数目之比为1∶2
④它们所含的H原子数目之比为1∶1
⑤它们所含的质子数目之比为5∶9
A、①②③ B、③④⑤ C、①②④ D、①②③④⑤
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三上学期第三次月考化学试卷(解析版) 题型:实验题
我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献,他以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱。有关反应的化学方程式为:
NH3+CO2+H2O+NaCl NaHCO3↓+NH4Cl ;2NaHCO3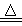 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
回答下列问题:
(1)氨气、二氧化碳与饱和食盐水反应,能析出碳酸氢钠晶体的原因是 (填字母标号)。
a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验。
①一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。
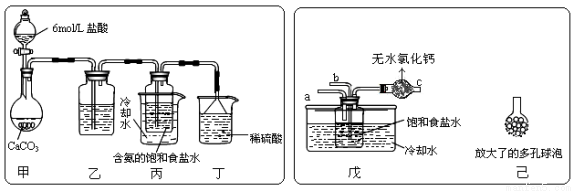
试回答下列有关问题:
 (Ⅰ)乙装置中的试剂是 ;
(Ⅰ)乙装置中的试剂是 ;
(Ⅱ)丁装置中稀硫酸的作用是 ;
(Ⅲ)实验结束后,分离出NaHCO3 晶体的操作是 (填分离操作的名称)。
②另一位同学用图中戊装置(其它装置未画出)进行实验。
(Ⅰ)实验时,须先从 管通入 气体,再从 管中通入 气体;
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是 ;
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省高一上期中测试化学试卷(解析版) 题型:选择题
下列反应的离子方程式中正确的是
A.铁与硫酸铜溶液反应:Fe+Cu2+═Fe2++Cu
B.向氢氧化钡中滴加硫酸溶液H++OH﹣═H2O
C.Mg与盐酸的反应:2Mg+2H+═2Mg2++H2↑
D.石灰石与稀HCl反应制备CO2:CO32﹣+2H+═H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高二上10月月考化学试卷(解析版) 题型:选择题
CoCl3·4NH3用H2SO4溶液处理再结晶,SO42—可以取代化合物中的Cl—,但NH3的含量不变,用过量的AgNO3处理该化合物,有含量1/3氯以AgCl析出,这种化合物应该是
A.[Co(NH3)4] Cl3 B.[Co(NH3)4 Cl3]
C.[Co(NH3)4 Cl] Cl2 D.[Co(NH3)4 Cl2] Cl
查看答案和解析>>
科目:高中化学 来源:2015-2016学年西藏拉萨中学高二上第一次月考化学试卷(解析版) 题型:选择题
在进行中和热的测定中,下列操作错误的是
A.反应前酸、碱溶液的温度要相同
B.环形玻璃棒搅拌能加快反应速率,减小实验误差
C.为了使反应均匀进行,可以向酸(碱)中分次加入碱(酸)
D.为了使反应更完全,可以使酸或碱适当过量
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁省高二上第一阶段测化学试卷(解析版) 题型:选择题
某温度下,向2 L恒容密闭容器中充入1.0 mol A和1.0 mol B,反应A(g)+B(g)  C(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是
C(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是
t/s | 0 | 5 | 15 | 25 | 35 |
n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
A.反应在前5 s的平均速率v(A)=0.17 mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时c(A)=0.41 mol·L-1,则反应的ΔH>0
C.相同温度下,起始时向容器中充入2.0 mol C,达到平衡时,C的转化率大于80%
D.相同温度下,起始时向容器中充入0.20 mol A、0.20 mol B和1.0 mol C,反应达到平衡前v(正)<v(逆)
查看答案和解析>>
科目:高中化学 来源:2016届山东省滕州市高三上学期10月月考化学试卷(解析版) 题型:填空题
(13分)(一)已知水的电离平衡曲线如图所示,试回答下列问题:

(1)E对应的温度下,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为_______ _
(2)B对应温度下,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积与原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=___________________
(二)膜技术原理在化工生产中有着广泛的应用。有人设想利用电化学原理制备少量硫酸和绿色硝化剂N2O5,装置图如下。
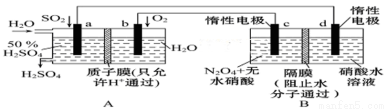
(1)A装置是________________,B装置是____________(填“原电池”或“电解池”)。
(2)N2O5在电解池的______________(填“c极”或“d极”)区生成,其电极反应式为__________________
(3)A装置中通入SO2一极的电极反应式为
(4)若A装置中通入SO2的速率为2.24 L·min-1(标准状况),为稳定持续生产,硫酸溶液的浓度应维持不变,则左侧水的流入速率应为_______________mL·min-1。
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三上学期10月月考化学试卷(解析版) 题型:选择题
某溶液中可能含有Na+、NH4+、Ba2+、SO42-、I-、S2-中的几种。分别取样:①用pH试纸测试,溶液显弱酸性;②加氯水和淀粉无明显现象。为确定该溶液的组成,还需检验的离子是
A.Na+ B.SO42- C.Ba2+ D.NH4+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com