
【题目】25℃时,下列说法正确的是( )
A.将pH=2的酸溶液稀释10倍,溶液的pH一定变为3
B.将pH=2的盐酸溶液和pH=4的盐酸溶液等体积混合后,溶滚的pH变为3
C.将pH=12的Ba(OH)2溶液稀释10倍,溶液的pH变为13
D.将pH=a的盐酸与pH=b的NaOH溶液等体积混合后,若pH=7, 则a+b=14
【答案】D
【解析】
试题分析:A.将pH=2的酸溶液稀释10倍,若为强酸,则溶液的pH变为3,若为弱电解质,稀释后弱酸的电离程度增大,溶液中氢离子的物质的量增大,溶液的pH小于3,故A错误;B.pH=2的盐酸溶液中氢离子浓度为0.01mol/L,pH=4的盐酸溶液中氢离子浓度为0.0001mol/L,两溶液等体积混合后,溶液中氢离子浓度为:![]() mol/L≠0.001,所以混合液的pH一定不是3,故B错误;C.pH=12的Ba(OH)2溶液中氢氧根离子浓度为0.01mol/L,稀释10倍后氢氧根离子浓度为0.001mol/L,稀释后溶液的pH变为11,故C错误;D.pH=a的盐酸中氢离子浓度为10-amol/L,pH=b的NaOH溶液中氢氧根离子浓度为:10b-14mol/L,两溶液等体积混合后,若pH=7,则两溶液的浓度一定相等,即:10-amol/L=10b-14mol/L,则a+b=14,故D正确;故选D。
mol/L≠0.001,所以混合液的pH一定不是3,故B错误;C.pH=12的Ba(OH)2溶液中氢氧根离子浓度为0.01mol/L,稀释10倍后氢氧根离子浓度为0.001mol/L,稀释后溶液的pH变为11,故C错误;D.pH=a的盐酸中氢离子浓度为10-amol/L,pH=b的NaOH溶液中氢氧根离子浓度为:10b-14mol/L,两溶液等体积混合后,若pH=7,则两溶液的浓度一定相等,即:10-amol/L=10b-14mol/L,则a+b=14,故D正确;故选D。


 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:高中化学 来源: 题型:
【题目】已知:H2、CO、CH4 、C3H8 的燃烧热分别是285.8 kJ/mol、283.0 kJ/mol,890.3 kJ/mol 、2220.0 kJ/mol ,则等质量的这几种气体燃烧,产生热量最多的是
A.C3H8 B.CO C.H2 D.CH4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取50.0mLNa2CO3和Na2SO4的混合溶液,加入过量BaCl2溶液后得到14.51g白色沉淀,用过量稀硝酸处理后沉淀量减少到4.66g,并有气体放出,试计算:
(1)原混合液中CO32-的物质的量浓度为,Na+的物质的量浓度为。
(2)产生的气体在标准状况下的体积L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下图所示装置中,试管A、B中的电极为多孔的惰性电极;C、D为两个铂夹,夹在被Na2SO4溶液浸湿的滤纸条上,滤纸条的中部滴有KMnO4液滴;电源有a、b两极。若在A、B中充满KOH溶液后倒立于KOH溶液的水槽中,断开K1,闭合K2、K3,通直流电,实验现象如图所示。

则:①标出电源的正、负极:a为________极,b为______极。
②在湿的Na2SO4滤纸条中部的KMnO4液滴处有什么现象发生?__________________
③写出电极反应式:C中______________,D中______________。
④若电解一段时间后,A、B中均有气体包围电极。此时切断K2、K3,闭合K1,则检流计的指针是否移动?___________(填“是”或“否”),其理由________________。写出电极反应式:A中 ,B中__ _。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2014年8月28日,第二届夏季青年奥林匹克运动会(以下简称“青奥会”)在南京奥体中心顺利闭幕。请完成下列与“青奥会”有关的填空。
(1)随着“青奥会”的举行,各种与城市建设相关的新材料接连不断地展现出。
①体育场馆需用大量的建筑材料。下列材料不属于硅酸盐材料的是 (填字母)。
a.石灰石 b.水泥 c.玻璃
②轨道交通建设需大量金属材料。下列金属材料最易发生腐蚀的是 (填字母)。
a.铝合金 b.钢铁 c.纯铜
(2)“青奥会”期间,要保障运动员的营养与健康。
①及时补充体能是运动员取得优秀成绩的基本保证。氨基酸是组成蛋白质的基本单元,其分子中所含官能团是 (填名称)和 (填名称);脂肪在人体内水解的产物是高级脂肪酸和 (填名称)。
②运动员还要合理吸收维生素。维生素C的结构简式如图所示,其分子式为 ;在氯化铁溶液中加入维生素C后,溶液由黄色转变为浅绿色,说明维生素C具有较强的 性(填“氧化”或“还原”)。

③服用违禁药物不仅妨碍体育竞技的公平、公正,也有害运动员的身心健康。在阿司匹林、青霉素、麻黄碱、小苏打等常用药物中,参赛选手不可服用的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g)ΔH=akJ·mol-1
2Fe(s)+3CO2(g)ΔH=akJ·mol-1
(1)已知:①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH1=+489.0kJ·mol-1
②C(石墨)+CO2(g)=2CO(g) ΔH2=+172.5kJ·mol-1,则a = kJ mol-1。
(2)冶炼铁反应的平衡常数表达式K = ,温度升高后,K值 (填“增大”、“不变”或“减小”)。
(3)在T℃时,该反应的平衡常数K=64,在2 L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
Fe2O3 | CO | Fe | CO2 | |
甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
①甲容器中CO的平衡转化率为 。
②下列说法正确的是 (填字母)。
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.甲容器中CO的平衡转化率大于乙的
c.甲、乙容器中,CO的平衡浓度之比为2∶3
d.增加Fe2O3可以提高CO的转化率
(4)采取一定措施可防止钢铁腐蚀。下列装置中的烧杯里均盛有等浓度、等体积的NaCl溶液。

①在a~c装置中,能保护铁的是 (填字母)。
②若用d装置保护铁,X极的电极材料应是 (填名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】RFC是一种将水电解技术与氢氧燃料电池技术向结合的可充电电池。下图为RFC工作原理示意图,下列有关说法正确的是
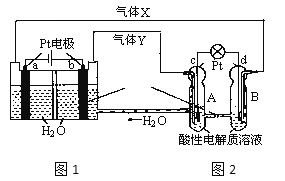
A.图1把化学能转化为电能,图2把电能转化为化学能,水得到了循环使用
B.当有0.1mol电子转移时,a极产生0.56LO2(标准状况下)
C.c极上发生的电极反应是:O2+4H++4e-=2H2O
D.图2中电子从c极流向d极,提供电能
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com