
【题目】下列化学用语书写正确的是( )
A.用电子式表示氢溴酸的形成过程为: ![]()
B.乙烯的结构简式:C2H4
C.四氯化碳的电子式为: ![]()
D.质子数为27、中子数为33的Co原子: ![]() Co
Co
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案科目:高中化学 来源: 题型:
【题目】根据元素周期表判断,下列叙述不正确的是( )
A. 周期表中第七周期最多容纳32种元素
B. 周期表中共有18个列,其中形成化合物种类最多的在第14列
C. 除过渡元素外周期表中最外层电子数相同的元素都位于同一族中
D. L层电子为奇数的所有元素所在族的序数与该元素原子的L层电子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X为一种常见酸的浓溶液,能使蔗糖变黑.A与X反应的转化关系如图所示,其中反应条件及部分产物已略去,下列有关说法正确的是( ) 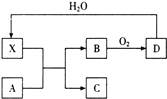
A.X能使蔗糖变黑主要体现了 X的强氧化性
B.若A为铁,则足量A与X在室温下即可完全反应
C.若A为碳单质,则将C通入少量澄清石灰水中,最终一定有白色沉淀产生
D.工业上,B转化为D的反应需使用催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列两种物质混合后不能发生离子反应的是( )
A. 稀硝酸和碳酸钠溶液混合
B. 氯化钠溶液和硝酸银溶液混合
C. 硫酸钾溶液和氯化钡溶液混合
D. 硝酸钾溶液和氯化钡溶液混合
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2O4(g)![]() 2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。
2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。

下列说法正确的是
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.由状态B到状态A,可以用加热的方法
D.A、C两点气体的平均相对分子质量:A>C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3是一种重要的化工原料,可用来制备肼、硝酸、硝酸铵和氯胺等。
(1)N2和H2以物质的量之比为1∶3在不同温度和压强下发生反应:N2+3H2![]() 2NH3,测得平衡体系中NH3的物质的量分数如右图。
2NH3,测得平衡体系中NH3的物质的量分数如右图。

① 下列途径可提高氨气产率的是________(填字母)。
a. 采用常温条件 b. 采用高温条件
c. 将原料气加压 d. 将氨液化,不断移去液氨
② 右图中所示的平衡体系中NH3的物质的量分数为0.549和0.478时,该反应的平衡常数分别为K1、K2,则K1________(填“>”“<”或“=”)K2。
(2)肼(N2H4)是一种火箭燃料。已知:
N2(g)+2O2(g)===2NO2(g);ΔH=+67.7 kJ·mol-1
N2H4(g)+O2(g)===N2(g)+2H2O(g);ΔH=-534.0 kJ·mol-1
NO2(g)===1/2N2O4(g);ΔH=-28.0 kJ·mol-1
① 反应2N2H4(g)+N2O4(g)===3N2(g)+4H2O(g)的ΔH=________kJ·mol-1。
② 氨气与次氯酸钠溶液反应生成肼的离子方程式为__________________________。
(3)电解硝酸工业的尾气NO可制备NH4NO3,其工作原理如右图。

① 阴极的电极反应式为____________________________________。
② 将电解生成的HNO3全部转化为NH4NO3,则通入的NH3与实际参加反应的NO的物质的量之比至少为________。
(4)饮用水消毒时,氯胺(NH2Cl等)在酸性条件下具有良好的效果(已知:NH2Cl+H2O≒NH3+HClO),其原因是__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化合物中依次属于氧化物、碱、盐的一组是
A.Na2CO3、KOH、CaO B.CO、NaOH、KCl
C.H2O、H2SO4、NaCl D.CuO、Cu2(OH)2CO3、CaCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】—定温度下,将2 mol SO2和1mol O2充入10 L恒容密闭容器中,发生反应2SO2(g) +O2(g)![]() 2SO3(g) △H =-196 kJ mol-1。5 min时达到平衡,测得反应放热166. 6 kJ。下列说法错误的是
2SO3(g) △H =-196 kJ mol-1。5 min时达到平衡,测得反应放热166. 6 kJ。下列说法错误的是
A. 0~5 min内,用O2表示的平均反应速率V(O2)=0.017 mol·L-1·min-1
B. ![]() 的值不变时,该反应达到平衡状态
的值不变时,该反应达到平衡状态
C. 若增大O2的浓度,SO2的转化率增大
D. 条件不变,若起始时充入4 mol SO2和2 mol O2,平衡时放出的热量小于333.2 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铅蓄电池为电源,石墨为电极电解CuSO4溶液,装置如下图。若一段时间后Y电极上有6.4 g红色物质析出,停止电解。下列说法正确的是

A. a为铅蓄电池的负极
B. 电解过程中,铅蓄电池的负极增重30.3g
C. 电解结束时,左侧溶液质量增重8g
D. 铅蓄电池工作时正极电极反应式为:PbSO4+2e-=Pb+SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com