
【题目】以铅蓄电池为电源,石墨为电极电解CuSO4溶液,装置如下图。若一段时间后Y电极上有6.4 g红色物质析出,停止电解。下列说法正确的是

A. a为铅蓄电池的负极
B. 电解过程中,铅蓄电池的负极增重30.3g
C. 电解结束时,左侧溶液质量增重8g
D. 铅蓄电池工作时正极电极反应式为:PbSO4+2e-=Pb+SO42-
【答案】C
【解析】Y电极上有6.4g红色物质析出,则m(Cu)=6.4g,n(Cu)=![]() =0.1mol,故Y电极上发生的电极反应为Cu2++2e-=Cu,则Y电极得电子发生还原反应,故Y为阴极,与阴极相连的为负极,即b为负极,在电解池中阴离子移向阳极。A.Y电极上发生的电极反应为Cu2++2e-=Cu,则Y电极得电子发生还原反应,故Y为阴极,与阴极相连的为负极,即b为负极,故A错误;B.铅蓄电池负极上Pb失电子和SO42-反应生成PbSO4,负极增加的质量为SO42-质量,Y电极上有6.4g红色物质析出,n(Cu)=
=0.1mol,故Y电极上发生的电极反应为Cu2++2e-=Cu,则Y电极得电子发生还原反应,故Y为阴极,与阴极相连的为负极,即b为负极,在电解池中阴离子移向阳极。A.Y电极上发生的电极反应为Cu2++2e-=Cu,则Y电极得电子发生还原反应,故Y为阴极,与阴极相连的为负极,即b为负极,故A错误;B.铅蓄电池负极上Pb失电子和SO42-反应生成PbSO4,负极增加的质量为SO42-质量,Y电极上有6.4g红色物质析出,n(Cu)=![]() =0.1mol,转移电子物质的量=0.1mol×2=0.2mol,负极反应式为Pb-2e-+SO42-=PbSO4,根据转移电子守恒得参加反应的n(SO42-)=0.1mol,则负极增加的质量m(SO42-)=0.1mol×96g/mol=9.6g,故B错误;C.右侧发生的电极反应为Cu2++2e-=Cu,n(Cu)=
=0.1mol,转移电子物质的量=0.1mol×2=0.2mol,负极反应式为Pb-2e-+SO42-=PbSO4,根据转移电子守恒得参加反应的n(SO42-)=0.1mol,则负极增加的质量m(SO42-)=0.1mol×96g/mol=9.6g,故B错误;C.右侧发生的电极反应为Cu2++2e-=Cu,n(Cu)=![]() =0.1mol,则n(e-)=0.2mol,则转移电子0.2mol,同时有
=0.1mol,则n(e-)=0.2mol,则转移电子0.2mol,同时有![]() =0.1molSO42-进入左侧,其质量为0.1mol×96g/mol=9.6g,且阳极上有
=0.1molSO42-进入左侧,其质量为0.1mol×96g/mol=9.6g,且阳极上有![]() =0.05molO2,其质量为0.05mol×32g/mol=1.6g,左侧溶液质量增加为9.6g-1.6g=8g,故C正确;D.铅蓄电池工作时正极电极反应式为4H++PbO2+2e-+SO42-=PbSO4↓+2H2O,故D错误;故选C。
=0.05molO2,其质量为0.05mol×32g/mol=1.6g,左侧溶液质量增加为9.6g-1.6g=8g,故C正确;D.铅蓄电池工作时正极电极反应式为4H++PbO2+2e-+SO42-=PbSO4↓+2H2O,故D错误;故选C。


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】下列化学用语书写正确的是( )
A.用电子式表示氢溴酸的形成过程为: ![]()
B.乙烯的结构简式:C2H4
C.四氯化碳的电子式为: ![]()
D.质子数为27、中子数为33的Co原子: ![]() Co
Co
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,10 mL 0.40 mol/L H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)( )
A. 0~6 min的平均反应速率: v(H2O2)≈3.3×10-2mol·L-1·min-1
B. 0~6 min的平均反应速率: v(H2O2)<3.3×10-2mol·L-1·min-1
C. 反应至6 min时,c(H2O2)=0.30 mol/L
D. 反应至6 min时,H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图,关闭活塞K,向A中充入1 molX、1 molY,向B中充入2 molX、2 molY,此时A、B的容积都是a L。在相同温度和催化剂存在的条件下,使两容器中各自发生下述反应:X(g)+Y(g) ![]() 2Z(g)+W(g);△H<0。A保持恒压,B保持恒容,达平衡时,A的体积为1.4a L。下列说法正确的是( )
2Z(g)+W(g);△H<0。A保持恒压,B保持恒容,达平衡时,A的体积为1.4a L。下列说法正确的是( )

A.反应速率:v(B)>v(A)
B.B容器中X的转化率为80%
C.平衡时的压强:2p(A)=p(B)
D.平衡时Y的体积分数:A>B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式与所述事实相符且正确的是
A. Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
B. 向含有0.4molFeBr2的溶液中通入0.3molCl2充分反应: 4Fe2++2Br-+3Cl2=4Fe3++6Cl-+Br2
C. 用惰性电极电解MgCl2溶液:2Cl-+2H2O![]() 2OH—+Cl2↑+H2↑
2OH—+Cl2↑+H2↑
D. 磁性氧化铁溶于稀硝酸:Fe3O4+8H++NO3-=3Fe3++NO↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知阿伏加德罗常数的值为NA。下列说法正确的是
A. 常温下,14 g的![]() C含中子数目为6NA
C含中子数目为6NA
B. 将含3NA个离子的Na2O2固体溶于水配成1L溶液,所得溶液中Na+的浓度为2mol/L
C. 用铂电极电解100 mL 1 mol L-1的CuSO4溶液足够长时间,转移电子数一定为0.2NA
D. 标准状况下,2.24LCCl4含有的共价键数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,又可作为燃料。一氧化碳与氢气可以合成甲醇:CO(g)+2H2(g)![]() CH3OH(g) ΔH<0
CH3OH(g) ΔH<0
(1)若该反应在恒温恒容条件下进行,下列说法正确的是_________;
a.若混合气体的平均摩尔质量不再改变,说明反应已达化学平衡状态
b.反应达到平衡后,通入氩气使压强增大,平衡向右移动,CO转化率增大
c.反应达到平衡后,升高温度,平衡逆向移动,平衡常数减小
d.若使用催化剂,会改变反应的途径,反应的焓变减小
(2)某温度下,在一个容积为2L的密闭容器中进行该反应,已知此温度下的平衡常数K=50 ![]() ,反应到某时刻测得各组分的物质的量如下:
,反应到某时刻测得各组分的物质的量如下:
物质 | CO | H2 | CH3OH |
物质的量/mol | 0.4 | 0.4 | 0.8 |
请比较此时正、逆反应速率的大小:v正 ____v逆(填“>”、“<”或“=”)
(3)CO平衡转化率(α)与温度和压强的关系如图所示。CO平衡转化率[α(CO)] 随温度升高而______(填“增大”或“减小”),其原因是_______。图中的压强由大到小的顺序为________,其判断理由是________。
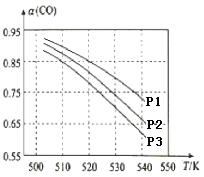
(4)在直接以甲醇为燃料的燃料电池中,若电解质溶液为酸性,则,负极的反应式为_______________________,正极的反应式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有11.2g KOH的稀溶液与1L 0.1molL﹣1的H2SO4溶液反应,放出11.46kJ的热量,下列热化学方程式正确的是( )
A.KOH(aq)+ ![]() ?H2SO4(aq)═
?H2SO4(aq)═ ![]() ?K2SO4(aq)+H2O(l)△H=﹣11.46 kJ?mol﹣1
?K2SO4(aq)+H2O(l)△H=﹣11.46 kJ?mol﹣1
B.2KOH(aq)+H2SO4(aq)═K2SO4(aq)+2H2O(l)△H=﹣11.46 kJ?mol﹣1
C.2KOH(aq)+H2SO4(aq)═K2SO4(aq)+2H2O(l)△H=+114.6 kJ?mol﹣1
D.KOH(aq)+ ![]() ?H2SO4(aq)═
?H2SO4(aq)═ ![]() ?K2SO4(aq)+H2O(l)△H=﹣57.3 kJ?mol﹣1
?K2SO4(aq)+H2O(l)△H=﹣57.3 kJ?mol﹣1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com