
【题目】甲醇是重要的化工原料,又可作为燃料。一氧化碳与氢气可以合成甲醇:CO(g)+2H2(g)![]() CH3OH(g) ΔH<0
CH3OH(g) ΔH<0
(1)若该反应在恒温恒容条件下进行,下列说法正确的是_________;
a.若混合气体的平均摩尔质量不再改变,说明反应已达化学平衡状态
b.反应达到平衡后,通入氩气使压强增大,平衡向右移动,CO转化率增大
c.反应达到平衡后,升高温度,平衡逆向移动,平衡常数减小
d.若使用催化剂,会改变反应的途径,反应的焓变减小
(2)某温度下,在一个容积为2L的密闭容器中进行该反应,已知此温度下的平衡常数K=50 ![]() ,反应到某时刻测得各组分的物质的量如下:
,反应到某时刻测得各组分的物质的量如下:
物质 | CO | H2 | CH3OH |
物质的量/mol | 0.4 | 0.4 | 0.8 |
请比较此时正、逆反应速率的大小:v正 ____v逆(填“>”、“<”或“=”)
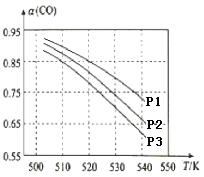
(3)CO平衡转化率(α)与温度和压强的关系如图所示。CO平衡转化率[α(CO)] 随温度升高而______(填“增大”或“减小”),其原因是_______。图中的压强由大到小的顺序为________,其判断理由是________。
(4)在直接以甲醇为燃料的燃料电池中,若电解质溶液为酸性,则,负极的反应式为_______________________,正极的反应式为________________________。
【答案】 a c = 减小 升高温度时,该反应为放热反应,平衡向向左移动,使得体系中CO的量增大; P1>P2>P3 相同温度下,由于该反应为气体分子数减小的反应,加压有利于提升CO的转化率 CH3OH+H2O-6e--═CO2+6H+ O2+4H++4e--═2H2O
【解析】(1)a.该反应前后气体的物质的量发生变化,但质量不变,混合气体的平均摩尔质量不再改变,说明反应已达化学平衡状态,故正确;b.反应达到平衡后,通入氩气,压强不变,但反应物和生成物的浓度不变,平衡不移动,CO转化率不变,故错误;c.反应达到平衡后,升高温度,平衡逆向移动,平衡常数减小,故正确;d.使用催化剂,会改变反应的途径,但反应的焓变不变,故错误;故答案为:a c;
(2)此时Qc=![]() =
=![]() =K=50L2mol-2,所以反应处于平衡状态,正、逆反应速率相等,故答案为:=;
=K=50L2mol-2,所以反应处于平衡状态,正、逆反应速率相等,故答案为:=;
(3)由图可知,压强一定时,随温度的升高,CO的转化率减小,正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡体系中CO的量增大, CO的转化率减小;该反应为气体分子数减小的反应,相同温度下,加压有利于提升CO的转化率,故压强:P1>P2>P3,故答案为:减小;该反应为放热反应,升高温度时,平衡向向左移动,使得体系中CO的量增大,CO的转化率减小;P1>P2>P3;相同温度下,正反应为气体分子数减小的反应,增大压强有利于提升CO的转化率;
(4)在直接以甲醇为燃料的燃料电池中,若电解质溶液为酸性,负极上甲醇发生氧化反应,反应式为CH3OH+H2O-6e--═CO2+6H+,正极上氧气发生还原反应,反应式为O2+4H++4e--═2H2O,故答案为:CH3OH+H2O-6e--═CO2+6H+;O2+4H++4e--═2H2O。


 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:
【题目】下列化合物中依次属于氧化物、碱、盐的一组是
A.Na2CO3、KOH、CaO B.CO、NaOH、KCl
C.H2O、H2SO4、NaCl D.CuO、Cu2(OH)2CO3、CaCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题: 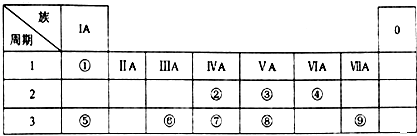
(1)⑨的原子结构示意图为 .
(2)②的气态氢化物分子的结构式为⑧的最高价氧化物的水化物的分子式 .
(3)②、③的最高价含氧酸的酸性由强到弱的顺序是 . (填化学式)
(4)⑤、⑥元素的金属性强弱依次 . (填“增大”、“减小”或“不变”)
(5)④、⑤、⑥形成的简单离子半径依次 . (填“增大”、“减小”或“不变”)
(6)①、④、⑤元素可形成既含离子键又含共价键的化合物,写出它的电子式 .
(7)⑤、⑥、⑨的最高价氧化物对应水化物两两均能反应,写出其反应的离子方程式.、、 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铅蓄电池为电源,石墨为电极电解CuSO4溶液,装置如下图。若一段时间后Y电极上有6.4 g红色物质析出,停止电解。下列说法正确的是

A. a为铅蓄电池的负极
B. 电解过程中,铅蓄电池的负极增重30.3g
C. 电解结束时,左侧溶液质量增重8g
D. 铅蓄电池工作时正极电极反应式为:PbSO4+2e-=Pb+SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黑火药发生爆炸的反应中:S+2KNO3+3C = K2S+N2↑+3CO2↑ 被还原的元素是
A. 只有NB. 只有SC. 只有CD. N和S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有甲、乙两种溶液:甲 pH=2(c(H+)=10-2 mol/L)的醋酸溶液乙 pH=2(c(H+)=10-2 mol/L)的盐酸,请根据下列操作回答问题:
(1)取10mL的甲溶液,加入等体积的水,醋酸的电离平衡___移动(填“向左”、“向右”或“不”);另取10mL的甲溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中c(H+)/c(CH3COOH)的比值将___(填“增大”、“减小”或“无法确定”)。
(2)相同条件下,取等体积的甲、乙两溶液,各稀释100倍。稀释后的溶液,其溶液中大小关系为:c(H+)(甲) ___c(H+) (乙)(填“大于”、“小于”或“等于”)。
(3)各取25mL的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为:V(甲)___________V(乙)(填“大于”、“小于”或“等于”)。
(4)下列事实能证明乙酸(CH3COOH)是弱电解质的是___.

A. 用乙酸(CH3COOH)溶液做导电性试验灯光较暗
B. 乙酸(CH3COOH)是共价化合物
C. 常温下,0.1 mol/L乙酸(CH3COOH)溶液的pH为2.2
D. 乙酸(CH3COOH)溶液不与NaCl反应
(5)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则Ka(HX) ______ Ka(CH3COOH)(填>、<或=)
(6)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中c(CH3COO)-c(Na+)=_________mol·L-1(填精确值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应的叙述正确的是( )
A.CuSO4稀溶液与Na反应析出Cu
B.Fe与水蒸气在高温下反应生成Fe2O3
C.SO2的水溶液与溴蒸气反应富集溴
D.饱和食盐水与通入的NH3、CO2反应析出Na2CO3固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有机物 CH3CH2COOCH3命名为_________________。
(2)写出丙烯发生加聚反应的方程式___________________________。
(3)C5H10属于烯烃的同分异构体有_________种,其氢气加成产物的一氯代物有3种的烯烃结构简式为________ (任意写其中一种即可)。
(4)等体积混合的两种气态烃共0.lmol,经充分燃烧后生成标况下CO23.36升和一定量的水,则其组合可能是____________。
A.CH4和C2H6 B.CH4和C2H4 C.CH4和C3H8 D.CH4和C3H6
(5)在![]() 溶液中通入足量的CO2的化学方程式为:_____________________。
溶液中通入足量的CO2的化学方程式为:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将纳米级微粒物质溶解于液体溶剂中形成一种分散系,对该分散系及分散质颗粒的下列叙述中不正确的是
A. 该分散系能产生丁达尔效应 B. 分散质颗粒能透过滤纸
C. 该分散质颗粒大小在1~100 nm之间 D. 该分散系很稳定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com