
【题目】现有甲、乙两种溶液:甲 pH=2(c(H+)=10-2 mol/L)的醋酸溶液乙 pH=2(c(H+)=10-2 mol/L)的盐酸,请根据下列操作回答问题:
(1)取10mL的甲溶液,加入等体积的水,醋酸的电离平衡___移动(填“向左”、“向右”或“不”);另取10mL的甲溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中c(H+)/c(CH3COOH)的比值将___(填“增大”、“减小”或“无法确定”)。
(2)相同条件下,取等体积的甲、乙两溶液,各稀释100倍。稀释后的溶液,其溶液中大小关系为:c(H+)(甲) ___c(H+) (乙)(填“大于”、“小于”或“等于”)。
(3)各取25mL的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为:V(甲)___________V(乙)(填“大于”、“小于”或“等于”)。
(4)下列事实能证明乙酸(CH3COOH)是弱电解质的是___.

A. 用乙酸(CH3COOH)溶液做导电性试验灯光较暗
B. 乙酸(CH3COOH)是共价化合物
C. 常温下,0.1 mol/L乙酸(CH3COOH)溶液的pH为2.2
D. 乙酸(CH3COOH)溶液不与NaCl反应
(5)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则Ka(HX) ______ Ka(CH3COOH)(填>、<或=)
(6)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中c(CH3COO)-c(Na+)=_________mol·L-1(填精确值)。
【答案】 向右 减小 大于 大于 C > 9.9×10-7
【解析】试题分析:本题考查一元强酸和一元弱酸的比较,外界条件对弱电解质电离平衡的影响,溶液中粒子浓度的大小关系。
(1)醋酸溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+,加水稀释离子结合成分子的机会减少,促进醋酸的电离,醋酸的电离平衡向右移动。加入少量无水醋酸钠,醋酸钠电离出CH3COO-,CH3COO-浓度增大,电离平衡逆向移动,c(H+)减小,c(CH3COOH)增大,溶液中c(H+)/ c(CH3COOH)的比值将减小。
CH3COO-+H+,加水稀释离子结合成分子的机会减少,促进醋酸的电离,醋酸的电离平衡向右移动。加入少量无水醋酸钠,醋酸钠电离出CH3COO-,CH3COO-浓度增大,电离平衡逆向移动,c(H+)减小,c(CH3COOH)增大,溶液中c(H+)/ c(CH3COOH)的比值将减小。
(2)相同条件下,取等体积的甲、乙两溶液,各稀释100倍,溶液的体积变成原来的100倍;醋酸是弱酸,加水稀释促进醋酸的电离,稀释后10-4mol/L![]() c(H+)(甲)
c(H+)(甲)![]() 10-2mol/L;盐酸为强酸,稀释后c(H+)(乙)=10-4mol/L;则稀释后c(H+)(甲)大于c(H+)(乙)。
10-2mol/L;盐酸为强酸,稀释后c(H+)(乙)=10-4mol/L;则稀释后c(H+)(甲)大于c(H+)(乙)。
(3)甲、乙的pH相等,醋酸为弱酸,盐酸为强酸,则醋酸(甲)物质的量浓度大于盐酸(乙)物质的量浓度,25mL的甲、乙溶液消耗NaOH物质的量:n(甲)大于n(乙),NaOH溶液的浓度相等,则消耗NaOH溶液的体积:V(甲)大于V(乙)。
(4)A项,用乙酸溶液做导电性试验灯光较暗,说明溶液中离子浓度小,离子浓度的大小与溶液的浓度、电解质的强弱都有关,浓度小的强电解质溶液的导电能力也很弱,不能证明乙酸是弱电解质;B项,共价化合物不一定是弱电解质如HCl、H2SO4等,乙酸是共价化合物不能证明乙酸是弱电解质;C项,常温下0.1mol/L乙酸溶液的pH为2.2![]() 1(0.1mol/L的一元强酸pH=1),溶液中c(H+)
1(0.1mol/L的一元强酸pH=1),溶液中c(H+)![]() 0.1mol/L,可证明乙酸是弱电解质;D项,乙酸溶液不与NaCl反应不能证明乙酸是弱电解质;答案选C。
0.1mol/L,可证明乙酸是弱电解质;D项,乙酸溶液不与NaCl反应不能证明乙酸是弱电解质;答案选C。
(5)由图像可知,将pH相等的CH3COOH与HX稀释同等倍数,HX的pH改变值![]() CH3COOH的pH改变值,则酸性:HX
CH3COOH的pH改变值,则酸性:HX![]() CH3COOH,则Ka(HX)
CH3COOH,则Ka(HX) ![]() Ka(CH3COOH)。
Ka(CH3COOH)。
(6)25℃pH=6的溶液中c(H+)=1![]() 10-6mol/L。在溶液中存在的电荷守恒为:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),则c(CH3COO-)- c(Na+)= c(H+)-c(OH-)=1
10-6mol/L。在溶液中存在的电荷守恒为:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),则c(CH3COO-)- c(Na+)= c(H+)-c(OH-)=1![]() 10-6mol/L-1
10-6mol/L-1![]() 10-8mol/L=9.9
10-8mol/L=9.9![]() 10/span>-7mol/L。
10/span>-7mol/L。
c(H+) | pH | 中和碱的能力 | 与足量活泼金属反应产生H2的量 | 与活泼金属反应开始的速率 | 稀释相同倍数后 | ||||||||
c | pH | ||||||||||||
HCl | 大 | 小 | 相同 | 相同 | 快 | 相同 | 小 | ||||||
HAc | 小 | 大 | 慢 | 大 | |||||||||
c(酸) | 与足量活泼金属反应 | 中和碱的能力 | 稀释相同倍数后 | ||||||||||
υ(初) | υ(后) | 产生H2量 | c(酸) | pH | |||||||||
HCl | 小 | 相同 | 慢 | 少 | 小 | 小 | 大 | ||||||
HAc | 大 | 快 | 多 | 大 | 大 | 小 | |||||||


 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:
【题目】NH3和纯净的O2在一定条件下发生反应:4NH3(g)+3O2(g)2N2(g)+6H2O(g),现向一容积不变的2L密闭容器中充入4mol NH3和3mol O2 , 4min后,测得生成的H2O占混合气体体积的40%,则下列表示此段时间内该反应的平均速率不正确的是( )
A.v(O2)=0.225 molL﹣1min﹣1
B.v(H2O)=0.375 molL﹣1min﹣1
C.v(N2)=0.125 molL﹣1min﹣1
D.v(NH3)=0.250 molL﹣1min﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图,关闭活塞K,向A中充入1 molX、1 molY,向B中充入2 molX、2 molY,此时A、B的容积都是a L。在相同温度和催化剂存在的条件下,使两容器中各自发生下述反应:X(g)+Y(g) ![]() 2Z(g)+W(g);△H<0。A保持恒压,B保持恒容,达平衡时,A的体积为1.4a L。下列说法正确的是( )
2Z(g)+W(g);△H<0。A保持恒压,B保持恒容,达平衡时,A的体积为1.4a L。下列说法正确的是( )

A.反应速率:v(B)>v(A)
B.B容器中X的转化率为80%
C.平衡时的压强:2p(A)=p(B)
D.平衡时Y的体积分数:A>B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知阿伏加德罗常数的值为NA。下列说法正确的是
A. 常温下,14 g的![]() C含中子数目为6NA
C含中子数目为6NA
B. 将含3NA个离子的Na2O2固体溶于水配成1L溶液,所得溶液中Na+的浓度为2mol/L
C. 用铂电极电解100 mL 1 mol L-1的CuSO4溶液足够长时间,转移电子数一定为0.2NA
D. 标准状况下,2.24LCCl4含有的共价键数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,又可作为燃料。一氧化碳与氢气可以合成甲醇:CO(g)+2H2(g)![]() CH3OH(g) ΔH<0
CH3OH(g) ΔH<0
(1)若该反应在恒温恒容条件下进行,下列说法正确的是_________;
a.若混合气体的平均摩尔质量不再改变,说明反应已达化学平衡状态
b.反应达到平衡后,通入氩气使压强增大,平衡向右移动,CO转化率增大
c.反应达到平衡后,升高温度,平衡逆向移动,平衡常数减小
d.若使用催化剂,会改变反应的途径,反应的焓变减小
(2)某温度下,在一个容积为2L的密闭容器中进行该反应,已知此温度下的平衡常数K=50 ![]() ,反应到某时刻测得各组分的物质的量如下:
,反应到某时刻测得各组分的物质的量如下:
物质 | CO | H2 | CH3OH |
物质的量/mol | 0.4 | 0.4 | 0.8 |
请比较此时正、逆反应速率的大小:v正 ____v逆(填“>”、“<”或“=”)
(3)CO平衡转化率(α)与温度和压强的关系如图所示。CO平衡转化率[α(CO)] 随温度升高而______(填“增大”或“减小”),其原因是_______。图中的压强由大到小的顺序为________,其判断理由是________。
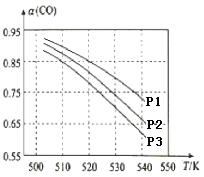
(4)在直接以甲醇为燃料的燃料电池中,若电解质溶液为酸性,则,负极的反应式为_______________________,正极的反应式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年,我国科学家屠呦呦因发现青蒿素而荣获诺贝尔奖。由青蒿素合成衍生药物蒿甲醚的合成路线如下:

下列说法正确的是
A. 蒿甲醚的化学式为C16H25O5
B. ①、②反应依次为加成反应、取代反应
C. 青蒿素因含酯基具有氧化性和杀菌功能
D. 上述三种有机物的含氧官能团完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有11.2g KOH的稀溶液与1L 0.1molL﹣1的H2SO4溶液反应,放出11.46kJ的热量,下列热化学方程式正确的是( )
A.KOH(aq)+ ![]() ?H2SO4(aq)═
?H2SO4(aq)═ ![]() ?K2SO4(aq)+H2O(l)△H=﹣11.46 kJ?mol﹣1
?K2SO4(aq)+H2O(l)△H=﹣11.46 kJ?mol﹣1
B.2KOH(aq)+H2SO4(aq)═K2SO4(aq)+2H2O(l)△H=﹣11.46 kJ?mol﹣1
C.2KOH(aq)+H2SO4(aq)═K2SO4(aq)+2H2O(l)△H=+114.6 kJ?mol﹣1
D.KOH(aq)+ ![]() ?H2SO4(aq)═
?H2SO4(aq)═ ![]() ?K2SO4(aq)+H2O(l)△H=﹣57.3 kJ?mol﹣1
?K2SO4(aq)+H2O(l)△H=﹣57.3 kJ?mol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一小块钠投入盛有5 mL饱和澄清石灰水的试管里,不可能观察到的现象是
A. 钠熔成小球并在液面上游动
B. 有气体生成
C. 试管底部有银白色物质生成
D. 溶液变浑浊
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com