
����Ŀ������ͼ���رջ���K����A�г���1 molX��1 molY����B�г���2 molX��2 molY����ʱA��B���ݻ�����a L������ͬ�¶Ⱥʹ������ڵ������£�ʹ�������и��Է���������Ӧ��X(g)+Y(g) ![]() 2Z(g)+W(g)����H<0��A���ֺ�ѹ��B���ֺ��ݣ���ƽ��ʱ��A�����Ϊ1.4a L������˵����ȷ���ǣ� ��
2Z(g)+W(g)����H<0��A���ֺ�ѹ��B���ֺ��ݣ���ƽ��ʱ��A�����Ϊ1.4a L������˵����ȷ���ǣ� ��

A����Ӧ���ʣ�v(B)>v(A)
B��B������X��ת����Ϊ80%
C��ƽ��ʱ��ѹǿ��2p(A)=p(B)
D��ƽ��ʱY�����������A>B
���𰸡�A
��������
���������A����X ��g��+Y��g��![]() 2Z��g��+W��g����˵����ʼʱֻ���뷴Ӧ��X��Y���÷�Ӧ��������Ӧ��������Խ�����ѧƽ�⣮������A��˵���ڽ�����ѧƽ��Ĺ����У���Ӧ�����������ʵ����������ݰ���٤�����ɣ�ͬ��ͬ��ʱ��ѹǿ֮�ȵ������ʵ���֮�ȣ��������Ҫ������ֵ����ʵ���Ũ�Ⱦ�Ҫ���£��䷴Ӧ����ҲҪ��С������B������˵��������䣬����ֳ�ʼŨ����A������2����ÿ��ʱ�̵ķ�Ӧ���ʶ�������A����������Ӧ���ʣ�v��B����v��A����A����ȷ��B.���ݰ���٤�����ɣ���ƽ������������ʵ����dz�ʼʱ���ʵ�����1.4������1.4��2mol=2.8mol����������0.8mol�����ݻ�ѧ����ʽ�ļ����֪��
2Z��g��+W��g����˵����ʼʱֻ���뷴Ӧ��X��Y���÷�Ӧ��������Ӧ��������Խ�����ѧƽ�⣮������A��˵���ڽ�����ѧƽ��Ĺ����У���Ӧ�����������ʵ����������ݰ���٤�����ɣ�ͬ��ͬ��ʱ��ѹǿ֮�ȵ������ʵ���֮�ȣ��������Ҫ������ֵ����ʵ���Ũ�Ⱦ�Ҫ���£��䷴Ӧ����ҲҪ��С������B������˵��������䣬����ֳ�ʼŨ����A������2����ÿ��ʱ�̵ķ�Ӧ���ʶ�������A����������Ӧ���ʣ�v��B����v��A����A����ȷ��B.���ݰ���٤�����ɣ���ƽ������������ʵ����dz�ʼʱ���ʵ�����1.4������1.4��2mol=2.8mol����������0.8mol�����ݻ�ѧ����ʽ�ļ����֪��
X ��g��+Y��g��![]() 2Z��g��+W��g����n
2Z��g��+W��g����n
1 1
0.8mol 0.8mol
����ƽ���Ӧ��0.8mol��A������X��ת����Ϊ80%��������B��˵���൱����Aƽ��Ļ���������ѹǿ��ƽ�������ƶ���X��ת��ΪС��80%��B�����C.Bƽ���൱����Aƽ��Ļ���������һ��ѹǿ����ƽ�ⲻ�ƶ���2p(A)=p(B)��ʵ���ϣ�ƽ�����淴Ӧ�����ƶ�����2p(A)>p(B)��C�����D.����C����A������ƽ��仯��������ƽ����ݻ�Ϊ0.5aL���ݻ�Ϊ1.4aL��ȣ�Y���������Ҫ��С����ƽ��ʱY�������A��B��D�����ѡA��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ʻ�Ϻ��ܷ������ӷ�Ӧ����(����)
A. ϡ�����̼������Һ���
B. �Ȼ�����Һ����������Һ���
C. �������Һ���Ȼ�����Һ���
D. �������Һ���Ȼ�����Һ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������¶��£���2 mol SO2��1mol O2����10 L�����ܱ������У�������Ӧ2SO2(g) +O2(g)![]() 2SO3(g) ��H =-196 kJ mol-1��5 minʱ�ﵽƽ�⣬��÷�Ӧ����166. 6 kJ������˵���������
2SO3(g) ��H =-196 kJ mol-1��5 minʱ�ﵽƽ�⣬��÷�Ӧ����166. 6 kJ������˵���������
A. 0��5 min�ڣ���O2��ʾ��ƽ����Ӧ����V(O2)=0.017 mol��L-1��min-1
B. ![]() ��ֵ����ʱ���÷�Ӧ�ﵽƽ��״̬
��ֵ����ʱ���÷�Ӧ�ﵽƽ��״̬
C. ������O2��Ũ�ȣ�SO2��ת��������
D. �������䣬����ʼʱ����4 mol SO2��2 mol O2��ƽ��ʱ�ų�������С��333.2 kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����6. 0 mol L-1 H2SO4��Һ��10 mLϡ����200 mL,�ٴ���ȡ��10 mL����10 mL��Һ��SO42-�����ʵ���Ũ����
A. 0.05 mol L-1 B. 0.30 mol L-1
C. 0.15 mol L-1 D. 0.5 mol L-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ΪԪ�����ڱ���һ���֣������Ԫ�آ١����ڱ��е�λ�ã��û�ѧ����ش��������⣺ 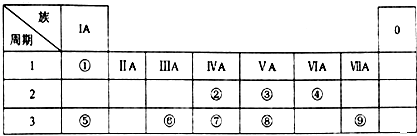
��1�����ԭ�ӽṹʾ��ͼΪ ��
��2���ڵ���̬�⻯����ӵĽṹʽΪ�������������ˮ����ķ���ʽ ��
��3���ڡ��۵���ۺ������������ǿ������˳���� �� ���ѧʽ��
��4���ݡ���Ԫ�صĽ�����ǿ������ �� �����������С�����䡱��
��5���ܡ��ݡ����γɵļ����Ӱ뾶���� �� �����������С�����䡱��
��6���١��ܡ���Ԫ�ؿ��γɼȺ����Ӽ��ֺ����ۼ��Ļ����д�����ĵ���ʽ ��
��7���ݡ��ޡ��������������Ӧˮ�����������ܷ�Ӧ��д���䷴Ӧ�����ӷ���ʽ������ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��һ����̬��������µ��ܶ�Ϊ1.25g/L������AΪ��Ҫԭ�Ϻϳ�һ�־��й���ζ������E����ϳ�·����ͼ��ʾ�� 
��1��д��A�Ľṹ��ʽ ��
��2��B��D���������������ŵ����Ʒֱ����� ��
��3������B����ֱ������ΪD����Ҫ������Լ��� ��
��4��д�����з�Ӧ�Ļ�ѧ����ʽ��
��Ӧ�ڵĻ�ѧ����ʽ������Ӧ���ͣ� ��
��Ӧ�ܵĻ�ѧ����ʽ������Ӧ���ͣ� ��
��5��B���ɺ����۵�ũ��Ʒ�����ס�С������Ⱦ����͡�������ã���д������ˮ��Ļ�ѧ����ʽ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ǧ����Ϊ��Դ��ʯīΪ�缫���CuSO4��Һ��װ������ͼ����һ��ʱ���Y�缫����6.4 g��ɫ����������ֹͣ��⡣����˵����ȷ����

A. aΪǦ���صĸ���
B. �������У�Ǧ���صĸ�������30.3g
C. ������ʱ�������Һ��������8g
D. Ǧ���ع���ʱ�����缫��ӦʽΪ��PbSO4+2e����Pb+SO42��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����мס���������Һ���� pH=2��c(H+)=10-2 mol/L���Ĵ�����Һ�� pH=2��c(H+)=10-2 mol/L�������ᣬ��������в����ش����⣺
��1��ȡ10mL�ļ���Һ������������ˮ������ĵ���ƽ��___�ƶ�������������������������������������ȡ10mL�ļ���Һ������������ˮ�����ƹ��壨����������ǰ����Һ������ֲ��䣩���������ܽ����Һ��c(H+)/c(CH3COOH)�ı�ֵ��___������������������С��������ȷ��������
��2����ͬ�����£�ȡ������ļס�������Һ����ϡ��100����ϡ�ͺ����Һ������Һ�д�С��ϵΪ��c(H+)(��) ___c(H+) (��)����������������С������������������
��3����ȡ25mL�ļס�������Һ���ֱ��õ�Ũ�ȵ�NaOHϡ��Һ�к�,�����ĵ�NaOH��Һ�������С��ϵΪ��V������___________V���ң�����������������С������������������
��4��������ʵ��֤�����ᣨCH3COOH����������ʵ���___.

A. �����ᣨCH3COOH����Һ������������ƹ�ϰ�
B. ���ᣨCH3COOH���ǹ��ۻ�����
C. �����£�0.1 mol/L���ᣨCH3COOH����Һ��pHΪ2.2
D. ���ᣨCH3COOH����Һ����NaCl��Ӧ
��5�������Ϊ100mL pH=2��CH3COOH��һԪ��HX����ˮϡ������pH����Һ����Ĺ�ϵ��ͼ��ʾ����Ka(HX) ______ Ka(CH3COOH)���������
��6��25��ʱ��CH3COOH��CH3COONa�Ļ����Һ�������pH=6������Һ��c(CH3COO)-c(Na+)=_________mol��L-1(�ȷֵ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й������Ӽ����˵������ȷ����
A. ��ij��Һ�м������ʯ��ˮ����Һ����ǣ������Һһ������CO32-
B. ��ij��Һ�м���AgNO3��Һ�����ɰ�ɫ����������Һ��һ������Cl��
C. ��ij��Һ�м������ữ��BaCl2��Һ���а�ɫ�������ɣ�����Һ��һ������SO42-
D. ��ij��Һ�м���2��KSCN��Һ����Һ���Ժ�ɫ��������Һ�мӼ������Ƶ���ˮ����Һ��Ϊ��ɫ������Һ��һ������Fe2��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com