
【题目】表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题: 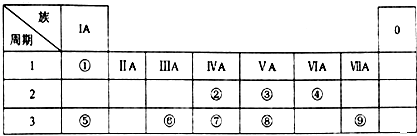
(1)⑨的原子结构示意图为 .
(2)②的气态氢化物分子的结构式为⑧的最高价氧化物的水化物的分子式 .
(3)②、③的最高价含氧酸的酸性由强到弱的顺序是 . (填化学式)
(4)⑤、⑥元素的金属性强弱依次 . (填“增大”、“减小”或“不变”)
(5)④、⑤、⑥形成的简单离子半径依次 . (填“增大”、“减小”或“不变”)
(6)①、④、⑤元素可形成既含离子键又含共价键的化合物,写出它的电子式 .
(7)⑤、⑥、⑨的最高价氧化物对应水化物两两均能反应,写出其反应的离子方程式.、、 .
【答案】
(1)![]()
(2)![]() ;H3PO4
;H3PO4
(3)HNO3>H2CO3
(4)减小
(5)减小
(6)![]()
(7)Al(OH)3+OH﹣=AlO2﹣+2H2O;H++OH﹣=H2O;Al(OH)3+3H+=Al3++3H2O
【解析】解:由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为Si、⑧为P、⑨为 Cl.
(1.)⑨为 Cl,原子核外电子数为17,各层电子数为2、8、7,原子结构示意图为: ![]() ,所以答案是:
,所以答案是: ![]() ;
;
(2.)②为C,气态氢化物为CH4 , 结构式为 ![]() ,⑧为P,最高价氧化物的水化物的分子式为H3PO4 , 所以答案是:
,⑧为P,最高价氧化物的水化物的分子式为H3PO4 , 所以答案是: ![]() ;H3PO4;
;H3PO4;
(3.)②、③分别为C、N,非金属性N>C,故最高价氧化物对应水化物的酸性HNO3>H2CO3 , 所以答案是:HNO3>H2CO3;
(4.)⑤、⑥元素分别为Na、Al,同周期从左到右金属性减弱,金属性钠大于铝,所以答案是:减小;
(5.)电子层数越多,半径越大,相同电子层数,原子序数越小半径越大,④、⑤、⑥形成的简单离子分别为O2﹣、Na+、Al3+ , 半径依次减小,所以答案是:减小;
(6.)H、O、Na元素可形成既含离子键又含共价键的化合物为氢氧化钠,电子式为 ![]() ,所以答案是:
,所以答案是: ![]() ;(7)⑤、⑥、⑨的最高价氧化物对应水化物分别为氢氧化钠、氢氧化铝、高氯酸,两两反应离子方程式分别为Al(OH)3+OH﹣=AlO2﹣+2H2O,H++OH﹣=H2O,Al(OH)3+3H+=Al3++3H2O,所以答案是:Al(OH)3+OH﹣=AlO2﹣+2H2O;H++OH﹣=H2O;Al(OH)3+3H+=Al3++3H2O.
;(7)⑤、⑥、⑨的最高价氧化物对应水化物分别为氢氧化钠、氢氧化铝、高氯酸,两两反应离子方程式分别为Al(OH)3+OH﹣=AlO2﹣+2H2O,H++OH﹣=H2O,Al(OH)3+3H+=Al3++3H2O,所以答案是:Al(OH)3+OH﹣=AlO2﹣+2H2O;H++OH﹣=H2O;Al(OH)3+3H+=Al3++3H2O.


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
【题目】在浓硝酸中放入铜片发生反应:
(1)待反应停止后,若铜有剩余,再加入少量25%的稀硫酸,这时铜片上又有气泡产生,原因是(用离子方程式表示)
(2)若将12.8g铜跟一定量的浓硝酸反应,铜耗完时,共产生气体5.6L(标况).则所消耗硝酸的物质的量是 mol
(3)将收集上述气体的容器倒扣在盛有水的水槽中,并向其中缓慢通入O2 , 使其充分反应,若要使水恰好充满容器,理论上需要参加反应的O2的物质的量是 mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年12月17日,我国第一艘国产航空母舰“中国人民解放军海军山东舰”在海南三亚某军港交付使用。其舰体使用了高强度、耐腐蚀的金属材料,该主体材料属于
A.玻璃B.合金钢C.塑料D.陶瓷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,10 mL 0.40 mol/L H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)( )
A. 0~6 min的平均反应速率: v(H2O2)≈3.3×10-2mol·L-1·min-1
B. 0~6 min的平均反应速率: v(H2O2)<3.3×10-2mol·L-1·min-1
C. 反应至6 min时,c(H2O2)=0.30 mol/L
D. 反应至6 min时,H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在C2H2、C6H6、C2H4O组成的混合物中,已知氧元素的质量分数为8%,则混合物中碳元素的质量分数是( )
A.92.3%
B.87.6%
C.75%
D.84%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图,关闭活塞K,向A中充入1 molX、1 molY,向B中充入2 molX、2 molY,此时A、B的容积都是a L。在相同温度和催化剂存在的条件下,使两容器中各自发生下述反应:X(g)+Y(g) ![]() 2Z(g)+W(g);△H<0。A保持恒压,B保持恒容,达平衡时,A的体积为1.4a L。下列说法正确的是( )
2Z(g)+W(g);△H<0。A保持恒压,B保持恒容,达平衡时,A的体积为1.4a L。下列说法正确的是( )

A.反应速率:v(B)>v(A)
B.B容器中X的转化率为80%
C.平衡时的压强:2p(A)=p(B)
D.平衡时Y的体积分数:A>B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式与所述事实相符且正确的是
A. Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
B. 向含有0.4molFeBr2的溶液中通入0.3molCl2充分反应: 4Fe2++2Br-+3Cl2=4Fe3++6Cl-+Br2
C. 用惰性电极电解MgCl2溶液:2Cl-+2H2O![]() 2OH—+Cl2↑+H2↑
2OH—+Cl2↑+H2↑
D. 磁性氧化铁溶于稀硝酸:Fe3O4+8H++NO3-=3Fe3++NO↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,又可作为燃料。一氧化碳与氢气可以合成甲醇:CO(g)+2H2(g)![]() CH3OH(g) ΔH<0
CH3OH(g) ΔH<0
(1)若该反应在恒温恒容条件下进行,下列说法正确的是_________;
a.若混合气体的平均摩尔质量不再改变,说明反应已达化学平衡状态
b.反应达到平衡后,通入氩气使压强增大,平衡向右移动,CO转化率增大
c.反应达到平衡后,升高温度,平衡逆向移动,平衡常数减小
d.若使用催化剂,会改变反应的途径,反应的焓变减小
(2)某温度下,在一个容积为2L的密闭容器中进行该反应,已知此温度下的平衡常数K=50 ![]() ,反应到某时刻测得各组分的物质的量如下:
,反应到某时刻测得各组分的物质的量如下:
物质 | CO | H2 | CH3OH |
物质的量/mol | 0.4 | 0.4 | 0.8 |
请比较此时正、逆反应速率的大小:v正 ____v逆(填“>”、“<”或“=”)
(3)CO平衡转化率(α)与温度和压强的关系如图所示。CO平衡转化率[α(CO)] 随温度升高而______(填“增大”或“减小”),其原因是_______。图中的压强由大到小的顺序为________,其判断理由是________。
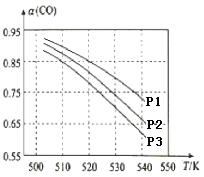
(4)在直接以甲醇为燃料的燃料电池中,若电解质溶液为酸性,则,负极的反应式为_______________________,正极的反应式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物的水溶液中,只可能含有以下离子中的若干种:K+、Mg2+、Fe3+、Al3+、NH4+、Cl﹣、CO32﹣和SO42﹣ . 现每次取10.00mL进行实验:
①第一份加入AgNO3溶液有沉淀产生;
②第二份加入足量NaOH后加热,收集到气体0.672L(标准状况下),但整个过程中无沉淀生成.
③第三份加入足量BaCl2溶液后得干燥沉淀6.63g,沉淀经足量盐酸洗涤,干燥后剩余4.66g.
请回答:
(1)c(CO32﹣)=mol/L.
(2)K+是否存在?(填“存在”或“不存在”);若存在,浓度范围是(若不存在,则不必回答第2问).
(3)根据以上实验,不能判断哪种离子是否存在? , 若存在,这种离子如何进行检验? .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com