
【题目】在C2H2、C6H6、C2H4O组成的混合物中,已知氧元素的质量分数为8%,则混合物中碳元素的质量分数是( )
A.92.3%
B.87.6%
C.75%
D.84%
【答案】D
【解析】解:C2H4O可以表示为C2H2 . H2O,故混合气体可以看做C6H6、C2H2、H2O的混合物,O元素的分数为8%,故H2O的质量分数为 ![]() =9%,故C6H6、C2H2总的质量分数1﹣9%=91%,C6H6、C2H2的最简式为CH,故C、H质量之比为12:1,故C元素的质量分数为91%×
=9%,故C6H6、C2H2总的质量分数1﹣9%=91%,C6H6、C2H2的最简式为CH,故C、H质量之比为12:1,故C元素的质量分数为91%× ![]() =84%,故选D.
=84%,故选D.
C2H4O可以表示为C2H2 . H2O,故混合气体可以看做C6H6、C2H2、H2O的混合物,根据O元素的分数计算H2O的质量分数,进而计算C6H6、C2H2总的质量分数,C6H6、C2H2的最简式为CH,故C、H质量之比为12:1,据此计算C元素的质量分数.


科目:高中化学 来源: 题型:
【题目】某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示:

FeCl3溶液 /含有淀粉的碘水/NaOH溶液
A B C
(1)SO2气体还原Fe3+的氧化产物是____________(填离子符号),参加该反应的SO2和Fe3+的物质的量之比是____________。
(2)下列实验方案适用于在实验室制取所需SO2的是____________(填序号)。
A.Na2SO3溶液与HNO3 B.Na2SO3固体与浓硫酸
C.固体硫在纯氧中燃烧 D.铜与热浓H2SO4
(3)装置C的作用是_______________________________________。
(4)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、过滤、自然干燥,在这一系列操作中没有用到的仪器有____________(填序号)。
A.蒸发皿 B.石棉网 C.漏斗 D.烧杯 E.玻璃棒 F.坩埚
(5)在上述装置中通入SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第二份试液加入铁氰化钾溶液,产生蓝色沉淀。
方案②:往第一份试液中加入KMnO4溶液,紫红色褪去。
方案③:往第三份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是________,原因是__________________________________。
(6)能表明I-的还原性弱于SO2的化学方程式为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题: 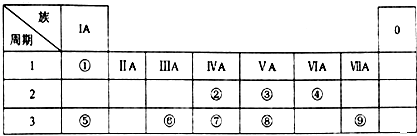
(1)⑨的原子结构示意图为 .
(2)②的气态氢化物分子的结构式为⑧的最高价氧化物的水化物的分子式 .
(3)②、③的最高价含氧酸的酸性由强到弱的顺序是 . (填化学式)
(4)⑤、⑥元素的金属性强弱依次 . (填“增大”、“减小”或“不变”)
(5)④、⑤、⑥形成的简单离子半径依次 . (填“增大”、“减小”或“不变”)
(6)①、④、⑤元素可形成既含离子键又含共价键的化合物,写出它的电子式 .
(7)⑤、⑥、⑨的最高价氧化物对应水化物两两均能反应,写出其反应的离子方程式.、、 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ⅰ)某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5 mol·L-1盐酸、0.55 mol·L-1NaOH溶液,实验尚缺少的玻璃用品是____、____。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?____(填“能”或“否”),其原因是______________________________________________________________。
(3)他们记录的实验数据如下:
实验用品 | 溶液温度 | 中和热 | |||
t1 | t2 | ΔH | |||
① | 50 mL 0.55 mol·L-1 NaOH溶液 | 50 mL 0.5 mol·L-1 HCl溶液 | 20 ℃ | 23.3 ℃ | |
② | 50 mL 0.55 mol·L-1 NaOH溶液 | 50 mL 0.5 mol·L-1 HCl溶液 | 20 ℃ | 23.5 ℃ | |
已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18 kJ·℃-1·kg-1,各物质的密度均为1 g·cm-3。
①计算完成上表中的ΔH。
(4)若用KOH代替NaOH,对测定结果____(填“有”或“无”)影响;若用醋酸代替HCl做实验,对测定结果____(填“有”或“无”)影响。
(Ⅱ)、在一定温度下,把2 mol N2和6 mol H2通入一个体积不变的密闭容器 中,(如右图 ):容器中发生以下的反应:N2(g)+3 H2(g)
):容器中发生以下的反应:N2(g)+3 H2(g)![]() 2NH3 (g) (正反应为放热反应)。若反应达到平衡后,测得混和气体为7 mol ,据此回答下列问题:保持上述反应温度不变,使a、b、c分别代表初始加入的N2、H2和NH3的物质的量,如果反应达到平衡后混和气体中各物质的物质的量分数仍与上述平衡时完全相同,那么:
2NH3 (g) (正反应为放热反应)。若反应达到平衡后,测得混和气体为7 mol ,据此回答下列问题:保持上述反应温度不变,使a、b、c分别代表初始加入的N2、H2和NH3的物质的量,如果反应达到平衡后混和气体中各物质的物质的量分数仍与上述平衡时完全相同,那么:
(1)若a=1 mol ,c=2 mol,则b=____ mol,在此情况下,反应起始时将向___方向进行(填 “正反应”或“逆反应”)
(2)若规定起始时反应向逆反应方向进行,则c的范围是_____。
(3)在上述装置中,若需控制平衡后的混和气体的物质的量为6.5 mol,则可采取的措施是_________
(III)、如图所示,温度不变时,把某容器分割成A、B两部分,A容器体积固定不变,B有可动的活塞,现在A中充入2 mol SO2和1 mol O2,在B中充入2 mol SO3和 1 mol N2,在相同条件下发生可逆反应:2 SO2(g)+O2(g) ![]() 2 SO3(g)。根据下列要求填写空白:
2 SO3(g)。根据下列要求填写空白:

(1)固定活塞位置在3处不动,达到平衡时,设A中压强为PA,B中压强为PB,则PA与PB的关系是PA_______PB(填“<”、“=”、“>”)。
(2)若要使A与B中平衡状态相同,可移动活塞的位置应在____处。
(3)若活塞右移到5处,达到平衡后,B中SO3为xmol,A中SO3为ymol, 则x和y 的关系是x____y. (填“<”、“=”、“>”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黑火药发生爆炸的反应中:S+2KNO3+3C = K2S+N2↑+3CO2↑ 被还原的元素是
A. 只有NB. 只有SC. 只有CD. N和S
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com