
【题目】某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示:

FeCl3溶液 /含有淀粉的碘水/NaOH溶液
A B C
(1)SO2气体还原Fe3+的氧化产物是____________(填离子符号),参加该反应的SO2和Fe3+的物质的量之比是____________。
(2)下列实验方案适用于在实验室制取所需SO2的是____________(填序号)。
A.Na2SO3溶液与HNO3 B.Na2SO3固体与浓硫酸
C.固体硫在纯氧中燃烧 D.铜与热浓H2SO4
(3)装置C的作用是_______________________________________。
(4)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、过滤、自然干燥,在这一系列操作中没有用到的仪器有____________(填序号)。
A.蒸发皿 B.石棉网 C.漏斗 D.烧杯 E.玻璃棒 F.坩埚
(5)在上述装置中通入SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第二份试液加入铁氰化钾溶液,产生蓝色沉淀。
方案②:往第一份试液中加入KMnO4溶液,紫红色褪去。
方案③:往第三份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是________,原因是__________________________________。
(6)能表明I-的还原性弱于SO2的化学方程式为__________________________________。
【答案】 )SO42- 1:2 BD 吸收SO2尾气,防止污染空气 BF 方案② 因为A的溶液中含有氯离子(或二氧化硫),氯离子或SO2也能使KMnO4溶液褪色 SO2 + I2 +2H2O == H2SO4 + 2HI
【解析】试题分析:
(1)反应为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,所以还原产物是Fe2+,参加反应的SO2和Fe3+的物质的量之比是1:2。
(2)A、硝酸具有强氧化性,把亚硫酸钠氧化成硫酸钠,得不到二氧化硫,错误;
B、浓硫酸虽具有强氧化性,但不能氧化生成的SO2,正确;
C、固体硫在纯氧中燃烧,操作不容易控制,错误;
D、铜和浓硫酸在加热条件下可以制得二氧化硫,正确。
(3)二氧化硫是酸性氧化物,具有刺激性气味,直接排放污染大气,能和碱反应生成盐和水,所以可用碱液处理二氧化硫,所以装置C的作用是吸收SO2尾气,防止污染空气;
(4)操作步骤:蒸发需用到蒸发皿,冷却结晶需用到烧杯,过滤需用到漏斗、玻璃棒,故不需要石棉网和坩埚。
(5)二氧化硫有还原性,高锰酸钾有强氧化性,二氧化硫能与高锰酸钾发生氧化还原反应使高锰酸钾溶液褪色,Fe2+也使高锰酸钾溶液褪色,所以不合理的是方案①,因为A的溶液中含有SO2,SO2也能使KMnO4溶液褪色。
(6)I2+SO2+2H2O=2HI+H2SO4;二氧化硫能使含有碘的淀粉溶液褪色,说明发生了氧化还原反应,碘是氧化剂,二氧化硫是还原剂,还原剂的还原性大于还原产物的还原性


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:
【题目】下列有关碱金属和卤素的说法正确的是( )
A. 从Li到Cs,单质的熔、沸点越来越高
B. 从F到I,单质与H2化合生成的氢化物越来越稳定
C. 从F到I,前一种单质都能把后一种单质从其盐溶液中置换出来
D. 从Li到Cs,最高价氧化物对应的水化物碱性越来越强,单质与水反应越来越剧烈
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1 mol·L-1的CH3COOH溶液中,下列关系正确的是
A. c(CH3COOH)>c(H+)>c(CH3COO-) >c(OH-)
B. c(CH3COO-)>c(CH3COOH>c(H+) >c(OH-)
C. c(CH3COOH)>c(CH3COO-)=c (H+)>c(OH-)
D. c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铁粉和硫粉混合后加热,待反应一发生即停止加热,反应仍可持续进行,直至反应完全生成新物质硫化亚铁。这现象说明了( )
A.该反应是放热反应
B.该反应是吸热反应
C.铁粉和硫粉在常温下可以发生反应
D.硫化亚铁的总能量高于铁粉和硫粉的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题: 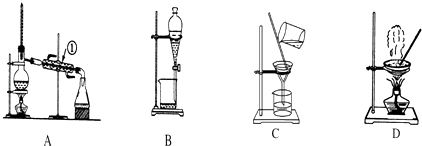
(1)从氯化钾溶液中得到氯化钾固体,选择装置(填代表装置图的字母,下同);除去自来水中的Cl﹣等杂质,选择装置 .
(2)从碘水中分离出I2 , 选择装置 , 该分离方法的名称为 .
(3)装置A中①的名称是 , 进水的方向是从口(上或下)进水.装置B在分液时为使液体顺利滴下,除打开漏斗下端的旋塞外,还应进行的具体操作是 .
(4)海水中蕴藏着丰富的资源,在实验室中取少量海水,进行如下流程的实验: [海水] ![]() [粗盐]
[粗盐] ![]() [食盐水]→[氯化钠晶体],粗盐中含Ca2+、Mg2+、Fe3+、SO
[食盐水]→[氯化钠晶体],粗盐中含Ca2+、Mg2+、Fe3+、SO ![]() 等杂质,需要提纯后才能综合利用.粗盐提纯的步骤有:
等杂质,需要提纯后才能综合利用.粗盐提纯的步骤有:
①加入过量的Na2CO3溶液②加入过量的BaCl2溶液③加入过量的NaOH溶液④调节溶液的pH等于7⑤溶解 ⑥过滤⑦蒸发正确的操作顺序是(填选项字母)
a.⑤②③①⑥④⑦b.⑤①②③⑥④⑦
c.⑤②①③④⑥⑦d.⑤③②①⑥④⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和铜是重要的过度元素,在工农业生产中有重要的作用。回答下列问题:
(1)铁元素在周期表中的位置__________________________:
(2)将铁粉、铜粉、FeCl3、FeCl2和CuCl2溶液混合于某容器中充分反应后。
试判断下列情况下,溶液中存在的金属离子和金属单质。
①若铁粉有剩余,则容器中不可能有:____________;
②若容器内还含有大量的Fe3+,则容器中会有:_______________ ;
③若容器内还有较多的Cu2+和相当量的Cu,则容器内不可能有_______________。
(3)某溶液中含有Fe3+、Br—,如何验证含有Fe2+________________________________?限定使用的试剂有:KSCN溶液、AgNO3溶液、新制的氯水、稀硝酸、NaOH溶液、酸性KMnO4溶液、双氧水。
(4)铜的冶炼方法之一:蓝铜矿(主要成分是2CuCO3·Cu(OH)2)它与焦炭一起加热时,可以生成铜、CO2、和水,写出该反应的化学方程式:________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com