
甲、乙、丙、丁、X是由短周期元素组成的纯净物,其中X为单质。上述物质转化关 系如下图所示(某些产物略去)。

请回答下列问题:
(1)若丁是一元强酸,甲→丁是工业生产丁的主要途径。
①写出反应I的化学方程式: 。
②常温下,1 mol丙发生反应III放出46kJ热量,该反应的热化学方程式为: 。
③在常温下,向V1L pH= 11的甲溶液中加入V2L pH=3的盐酸,若反应后溶液的pH<7,则V1和V2的关系为V1 V2(选填“>”、“<”或“=”),所得溶液中各种离子的浓度由大到小的顺序可能是: (写一种即可)。
(2)若丁是二元弱酸,丙是温室气体。
在容积为2L的容积固定的密闭容器中,将乙(g)和H2O(g)按下表用量分别进行反应:乙(g)+H2O(g)  丙(g) + H2(g),得到如下数据:
丙(g) + H2(g),得到如下数据:

①该反应的正反应为 (填“吸热”或“放热”)反应。
②900℃时,上述反应按如下起始量分别加入该容器:

则此时反应的v(正) v(逆)(填“>”、“<”或“=”)。
③实验3跟实验2相比,改变的条件可能是 。
(15分)(1)①4NH3+5O2 4NO+6H2O(3分)
4NO+6H2O(3分)
②3NO2(g)+H2O(l)==2HNO3(aq)+NO(g) △H=—138kJmol—1(3分)
③<(1分) c(Cl—)>c(NH4+)>c(H+)>c(OH—)或c(Cl—)>c(H+)>c(NH4+)>c(OH—)(2分)
(2)①放热(2分) ②<(2分) ③使用了催化剂(2分)
【解析】
试题分析:(1)①由已知信息可知,甲、乙、丙、丁、X分别是NH3、NO、NO2、HNO3、O2,则I的反应式为4NH3+5O2 4NO+6H2O;②由题意可知,NO2(g)+1/3H2O(l)=2/3HNO3(aq)+1/3NO(g)
△H=—46kJ/mol,或3NO2(g)+H2O(l)==2HNO3(aq)+NO(g)
△H=—138kJmol—1;③若V1=V2,则c(NH3•H2O)>c(HCl),由c•V可知碱过量,则混合溶液呈碱性,故V1<V2,混合溶液才可能显酸性;若盐酸过量程度较小,则酸性混合溶液中c(Cl—)>c(NH4+)>c(H+)>c(OH—),若盐酸过量程度较大,则c(Cl—)>c(H+)>c(NH4+)>c(OH—);(2)①由已知信息可知,甲、乙、丙、丁、X分别是C或CH4、CO、CO2、H2CO3、O2,则
4NO+6H2O;②由题意可知,NO2(g)+1/3H2O(l)=2/3HNO3(aq)+1/3NO(g)
△H=—46kJ/mol,或3NO2(g)+H2O(l)==2HNO3(aq)+NO(g)
△H=—138kJmol—1;③若V1=V2,则c(NH3•H2O)>c(HCl),由c•V可知碱过量,则混合溶液呈碱性,故V1<V2,混合溶液才可能显酸性;若盐酸过量程度较小,则酸性混合溶液中c(Cl—)>c(NH4+)>c(H+)>c(OH—),若盐酸过量程度较大,则c(Cl—)>c(H+)>c(NH4+)>c(OH—);(2)①由已知信息可知,甲、乙、丙、丁、X分别是C或CH4、CO、CO2、H2CO3、O2,则
CO(g) + H2O(g)  CO2(g)
+ H2(g)
CO2(g)
+ H2(g)
各组分的起始浓度/mol•L—1 2 1 0 0
各组分的变化浓度/mol•L—1 0.8 0.8 0.8 0.8
各组分的平衡浓度/mol•L—1 1.2 0.2 0.8 0.8
650℃时,K=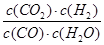 =
=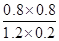 =8/3
=8/3
CO(g)
+ H2O(g)  CO2(g)
+ H2(g)
CO2(g)
+ H2(g)
各组分的起始浓度/mol•L—1 1 0.5 0 0
各组分的变化浓度/mol•L—1 0.2 0.2 0.2 0.2
各组分的平衡浓度/mol•L—1 0.8 0.3 0.2 0.2
900℃时,K=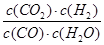 =
=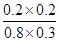 =1/6
=1/6
650℃→900℃时,K减小,则升高温度,平衡向逆反应方向移动,所以正反应是放热反应;
②900℃时,Q=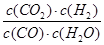 =
=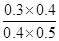 =3/5>1/6,说明该反应应向逆反应方向移动,才能达到该温度下的化学平衡,故v(逆)>v(正);实验2和3的平衡没有移动,但反应速率加快,说明2→3可能使用了催化剂。
=3/5>1/6,说明该反应应向逆反应方向移动,才能达到该温度下的化学平衡,故v(逆)>v(正);实验2和3的平衡没有移动,但反应速率加快,说明2→3可能使用了催化剂。
考点:考查硝酸的工业制法、氨的催化氧化、热化学方程式、溶液的酸碱性、电解质溶液中离子浓度大小关系、化学平衡常数、温度对化学平衡的影响、化学反应进行的方向、影响化学反应速率和化学平衡的因素等相关知识。


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com