
| A.反应后溶液中无硝酸亚铁 |
B.反应前HNO3溶液的浓度为2.0mol |
C.反应后溶液中c(NO3-)=1.6mol |
| D.反应后的溶液最多还能溶解1.6lgFe |
 ,所以B错误;反应后溶液中n(NO3-)=" 3×2.8/56+0.01=0.16mol," c(NO3-)=1.6mol
,所以B错误;反应后溶液中n(NO3-)=" 3×2.8/56+0.01=0.16mol," c(NO3-)=1.6mol ,C正确;原硝酸能溶解的Fe的最大质量为 0.21mol×3/8×56= 4.41g,故 能再溶解的Fe的质量为4.41g-2.8g=1.61g故D正确( 3 Fe+8HNO3=3Fe(NO3)2 +2 NO↑+4H2O (稀硝酸不足)。
,C正确;原硝酸能溶解的Fe的最大质量为 0.21mol×3/8×56= 4.41g,故 能再溶解的Fe的质量为4.41g-2.8g=1.61g故D正确( 3 Fe+8HNO3=3Fe(NO3)2 +2 NO↑+4H2O (稀硝酸不足)。

科目:高中化学 来源:不详 题型:填空题
 3Cu2++2R+yH2O。
3Cu2++2R+yH2O。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 +O2↑。下列对此反应的说法中,不正确的是( )
+O2↑。下列对此反应的说法中,不正确的是( )| A.方框中的物质为Na2SO4 |
| B.Na2O2既是氧化剂,又是还原剂 |
| C.Na2FeO4既是氧化产物,又是还原产物 |
| D.2 mol FeSO4发生反应时,反应中共转移8 mol电子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
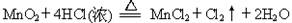
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2mol | B.4 mol | C.6 mol | D.8 mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
|
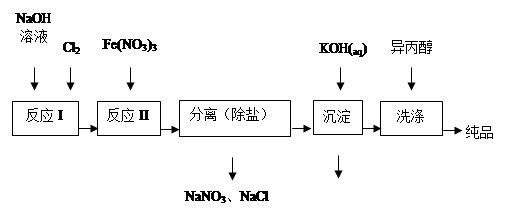 ①洗涤粗品时选用异丙醇而不用水的理由是: 。
①洗涤粗品时选用异丙醇而不用水的理由是: 。| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.上述测定不能达到实验目的 | B.剩余的7.48g金属为铜 |
| C.共生成NO气体 0.04mol | D.该合金中铜的质量分数为69.2% |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.若管道漏气遇氨就会产生白烟 | B.该反应利用了Cl2的强氧化性 |
| C.该反应NH3被还原 | D.生成1 mol N2有6 mol电子转移 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com