
|
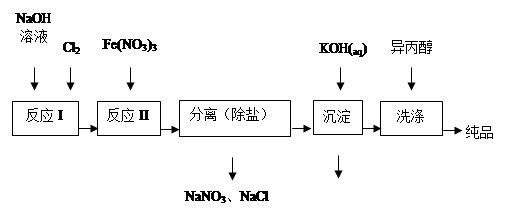 ①洗涤粗品时选用异丙醇而不用水的理由是: 。
①洗涤粗品时选用异丙醇而不用水的理由是: 。| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |


科目:高中化学 来源:不详 题型:单选题

A.电解时发生反应的化学方程式为2HCl Cl2↑+H2↑ Cl2↑+H2↑ |
| B.由NaClO2溶液制取0.6 mol ClO2时,至少消耗0.1 mol NCl3 |
| C.将产生的混合气体通过盛有碱石灰的干燥器以除去ClO2中的NH3 |
| D.溶液X的主要成分为NaClO2和NaOH |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
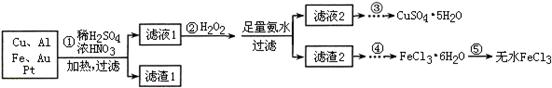
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗Na2S2O3标准溶液(mL) | 25.00 | 25.02 | 26.20 | 24.98 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 Fe3O4+S4O62-+2H2O,有关说法正确的是
Fe3O4+S4O62-+2H2O,有关说法正确的是| A.每转移1.5mol电子,有1.125mol Fe2+被氧化 |
| B.x = 2 |
| C.Fe2+、S2O32-都是还原剂 |
| D.每生成1mol Fe3O4,转移电子2mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.反应后溶液中无硝酸亚铁 |
B.反应前HNO3溶液的浓度为2.0mol |
C.反应后溶液中c(NO3-)=1.6mol |
| D.反应后的溶液最多还能溶解1.6lgFe |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2H2↑+O2↑,下列有关判断正确的是
2H2↑+O2↑,下列有关判断正确的是| A.氧化剂是氢元素 |
| B.还原产物是O2 |
| C.H2O既有氧化性也有还原性 |
| D.2molH2O反应,转移了8mol电子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CO(NH2)2 (l) + H2O (l)。
CO(NH2)2 (l) + H2O (l)。 ,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是___________。
,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是___________。
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2 mol | B.1 mol | C.0.5 mol | D.0.25 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com