
| A、CuCl2=Cu+Cl2↑ |
| B、Na2CO3=2Na++CO32- |
| C、H2SO4=2H++S6++4O2- |
| D、NaHCO3=Na++H++CO32- |


科目:高中化学 来源: 题型:
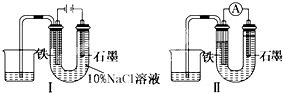 用如图Ⅰ所示装置通电10分钟后,去掉直流电源,连接成图Ⅱ所示装置,可观察到U形管左端铁电极表面析出白色胶状物质,U形管右端液面上升.下列说法正确的是( )
用如图Ⅰ所示装置通电10分钟后,去掉直流电源,连接成图Ⅱ所示装置,可观察到U形管左端铁电极表面析出白色胶状物质,U形管右端液面上升.下列说法正确的是( )| A、用装置Ⅱ进行实验时铁电极的电极反应为Fe-2e-+2OH-=Fe(OH)2 |
| B、装置Ⅰ通电10分钟后铁电极周围溶液pH降低 |
| C、用装置Ⅱ进行实验时石墨电极的电极反应为2H++2e-=H2↑ |
| D、同温、同压下,装置Ⅰ中石墨电极上方得到的气体比铁电极上方得到的气体多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将1.0molFeCl3全部制成胶体,其中氢氧化铁胶粒为NA个 |
| B、常温常压下,16 g氧气和臭氧(O3)的混合气体中含有NA 个氧原子 |
| C、12g NaHSO4在熔融时离子总数为0.3NA个 |
| D、标准状况下,11.2L氦气所含的原子数为NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO的摩尔质量为28 |
| B、常温常压下,NA个氢原子与NA 个氮气的质量比为1:14 |
| C、32克O2所含原子数目为2NA |
| D、常温常压下,1molCO分子所占体积是22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.3mol/L |
| B、0.05mol/L |
| C、0.04mol/L |
| D、0.03mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:1 | B、2:1 |
| C、2:3 | D、3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
12 6 |
13 6 |
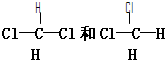 E.CH3CH2CH2CH3和
E.CH3CH2CH2CH3和
查看答案和解析>>
科目:高中化学 来源: 题型:
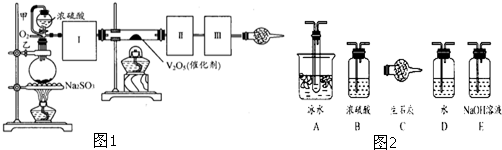
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com