
| A. | 反应每脱去1mol Cl2会生成1molSO42- | |
| B. | 脱氯反应后的溶液显酸性 | |
| C. | 根据该反应可判断还原性:S2O32->Cl- | |
| D. | 反应中硫元素发生了氧化反应 |
分析 S2O32-+Cl2+H2O→SO42-+Cl-+H+中,S元素的化合价由+2价升高为+6价,Cl元素的化合价由0降低为-1价,以此来解答.
解答 解:A.反应中每脱去1mol Cl2会转移2mol电子,由电子守恒可知生成$\frac{2mol}{6-2}$=0.5mol SO42-,故A错误;
B.由反应可知生成氢离子,酸性增强,故B正确;
C.由还原剂的还原性大于还原产物的还原性可知,还原性:S2O32->Cl-,故C正确;
D.S元素的化合价升高,发生氧化反应,故D正确;
故选A.
点评 本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LHF中含有的分子数目为NA | |
| B. | .1 L 0.1mol/L 的FeCl3溶液中,Fe3+的数目为0.1NA | |
| C. | .标准状况下,2.24LCl2溶于水,转移的电子数目为0.1NA | |
| D. | .5.6gFe在0.1molCl2中充分燃烧,转移的电子数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
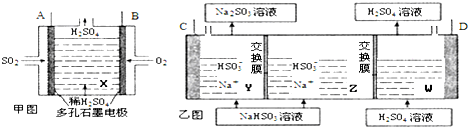
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
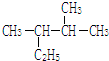 用系统命名法命名:2,3-二甲基戊烷;
用系统命名法命名:2,3-二甲基戊烷;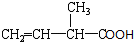 含氧官能团的名称是羧基;
含氧官能团的名称是羧基;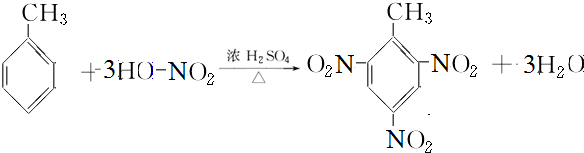 ;
; ;
;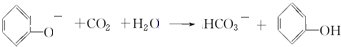 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质 | |
| B. | 25℃时、用醋酸溶液滴定等浓度NaOH溶液至pH=7,V醋酸>VNaOH | |
| C. | 在蒸馏水中滴加浓H2SO4,KW不变 | |
| D. | NaCl 溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| W | X | ||
| Y | Z |
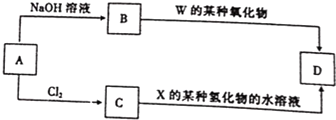
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠投入到Na2SO4溶液中 | B. | BaCl2和NaHSO4溶液反应 | ||
| C. | 小苏打溶液和澄清石灰水反应 | D. | Na2O2和CuSO4溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
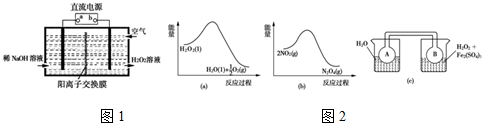
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| Cu的平均溶解速率 (×10-3mol•min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com