
| W | X | ||
| Y | Z |
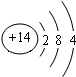
分析 短周期元素W、X、Y、Z,Z元素的单质是一种重要的半导体材料,则Z为Si元素,由元素在周期表中的位置可知,Y为镁元素、W为碳元素、X为氮元素.
(1)主族元素周期数=电子层数,主族族序数=最外层电子数;
(2)Si原子核外有14个电子,有3个电子层,各层电子数为2、8、4;
(3)电子层结构相同的离子,核电荷数越大离子半径越小;
(4)元素的非金属性越强,对应的气态氢化物越稳定,其最高价氧化物的水化物酸性越强,与原子序数及化合价无关;
(5)Y的最高价氧化物对应水化物为Mg(OH)2,属于弱碱;
(6)金属铝在第三周期,能与氢氧化钠反应生成偏铝酸钠,能与氯气该反应生成氯化铝,偏铝酸钠与二氧化碳反应生成氢氧化铝白色沉淀,氯化铝与一水合氨反应生成氢氧化铝沉淀,故B中的溶质是偏铝酸钠.
解答 解:短周期元素W、X、Y、Z,Z元素的单质是一种重要的半导体材料,则Z为Si元素,由元素在周期表中的位置可知,Y为镁元素、W为碳元素、X为氮元素.
(1)W为碳,C在元素周期表中的位置是:第二周期第ⅣA族,故答案为:第二周期第ⅣA族;
(2)Z为Si,Si的原子结构示意图为: ,故答案为:
,故答案为: ;
;
(3)电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:N3->Mg2+,故答案为:N3-;
(4)元素的非金属性越强,对应的气态氢化物越稳定,其最高价氧化物的水化物酸性越强,与原子序数及化合价无关,故答案为:CD;
(5)Y的最高价氧化物对应水化物为Mg(OH)2,属于弱碱,电离方程式为:Mg(OH)2?Mg2++2OH-,故答案为:Mg(OH)2?Mg2++2OH-;
(6)金属铝在第三周期,能与氢氧化钠反应生成偏铝酸钠,能与氯气该反应生成氯化铝,偏铝酸钠与二氧化碳反应生成氢氧化铝白色沉淀,氯化铝与一水合氨反应生成氢氧化铝沉淀,故B中的溶质是偏铝酸钠,化学式为NaAlO2,氯化铝与一水和氨反应生成氢氧化铝沉淀,离子反应方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+,
故答案为:NaAlO2;Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
点评 本题考查位置结构性质的关系及应用,涉及元素周期律、微粒半径比较、无机物推断等,题目难度中等.


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 人类历史上使用最早的合金是青铜 | |
| B. | 目前世界上用量最大的合金是钢 | |
| C. | 改变原料的配比、改变生成合金的条件,可以得到具有不同性质的合金 | |
| D. | 一般合金的熔点高于它的各成分金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl-→SO3-→石墨-→液氧 | B. | NaCl-→乙醇-→铁-→空气 | ||
| C. | 蔗糖-→CuSO4-→氮气-→波尔多液 | D. | KCl-→NaNO3-→氯气-→石灰水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2(g)+3H2(g) $?_{高温高压}^{催化剂}$2NH3(g)△H=-93 kJ•mol-1 | |
| B. | N2(g)+3H2(g) $?_{高温高压}^{催化剂}$2NH3(g)△H=+1471 kJ•mol-1 | |
| C. | N2(g)+3H2(g) $?_{高温高压}^{催化剂}$2NH3(g)△H=+93 kJ•mol-1 | |
| D. | N2(g)+3H2(g) $?_{高温高压}^{催化剂}$2NH3(g)△H=-1471 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应每脱去1mol Cl2会生成1molSO42- | |
| B. | 脱氯反应后的溶液显酸性 | |
| C. | 根据该反应可判断还原性:S2O32->Cl- | |
| D. | 反应中硫元素发生了氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液体均一,呈紫红色 | |
| B. | 液体分两层,上层为紫红色,下层为无色 | |
| C. | 液体分两层,上层为无色,下层为紫红色 | |
| D. | 液体均一,呈无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol•L-1 | 0.08 | 0.20 | 0.44 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com