
分析 (1)H2A是二元弱酸,其发生两步电离,且第一步电离程度远远大于第二步电离,NaHA溶液显酸性,说明HA-电离程度大于水解程度,钠离子不水解,再结合电荷守恒分析解答;
(2)常温时,若向0.1mol/L的NaHA溶液中逐滴滴加0.1mol/L KOH溶液至溶液呈中性,溶液中溶质为Na2A、NaHA,则c(H+)=c(OH );NaHA溶液呈碱性,要使混合溶液呈中性,n(NaHA)>n(KOH),再结合电荷守恒、物料守恒分析解答.
解答 解:(1)H2A是二元弱酸,其发生两步电离,且第一步电离程度远远大于第二步电离,NaHA溶液显酸性,说明HA-电离程度大于水解程度,且其程度都较小,钠离子不水解,HA-和水电离都生成氢离子,只有HA-电离生成A2-,所以离子浓度大小顺序是c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-),故答案为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-);
(2)常温时,若向0.1mol/L的NaHA溶液中逐滴滴加0.1mol/L KOH溶液至溶液呈中性,溶液中溶质为Na2A、NaHA,则c(H+)=c(OH );NaHA溶液呈碱性,要使混合溶液呈中性,n(NaHA)>n(KOH),
A.因为n(NaHA)>n(KOH),且钠离子、钾离子都不水解,所以存在c(Na+ )>c(K+ ),故A正确;
B.离子积常数只与温度有关,温度不变,离子积常数不变,所以常温下c(H +)•c(OH )=1×10-14,故B正确;
C.根据A知c(Na+ )>c(K+ ),故C错误;
D.溶液呈中性,则c(H+)=c(OH ),结合电荷守恒得c(Na+ )+c(K+ )=c(HA- )+2c(A2-),故D错误;
故选AB.
点评 本题考查离子浓度大小比较,明确溶液中溶质及其性质是解本题关键,注意电荷守恒和物料守恒的灵活运用,难点是(2)NaHA、KOH物质的量相对大小判断,题目难度中等.


科目:高中化学 来源: 题型:解答题
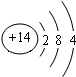
| W | X | ||
| Y | Z |
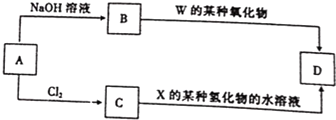
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
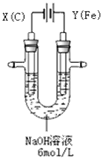 高铁酸钾(K2FeO4)具有高效的消毒作用,为一种新型非氯高效消毒剂.电解法制备高铁酸钾操作简便,成功率高,易于实验室制备.其原理如图所示.
高铁酸钾(K2FeO4)具有高效的消毒作用,为一种新型非氯高效消毒剂.电解法制备高铁酸钾操作简便,成功率高,易于实验室制备.其原理如图所示. 查看答案和解析>>
科目:高中化学 来源: 题型:解答题
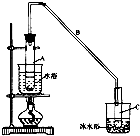 环己烯是一种重要的化工原料.
环己烯是一种重要的化工原料. .
.| 密度 (g/cm3) | 熔点 (℃) | 沸点 (℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑥⑨ | B. | ①②③④ | C. | ②⑥⑨⑩ | D. | ③⑤⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH溶液 | B. | AgNO3溶液 | C. | Ba(OH)2溶液 | D. | BaCl2溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com