
| A、Cu与浓H2SO4反应放出气体:Cu+2H+═Cu2++H2↑ |
| B、稀H2SO4与BaCl2溶液反应生成沉淀:Ba2++SO42-═BaSO4↓ |
| C、用大理石与稀盐酸制备CO2:CaCO3+2H+═Ca2++CO2↑+H2O |
| D、盛放NaOH溶液的试剂瓶不能用玻璃塞:SiO2+2OH-═SiO32-+H2O |
| ||


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
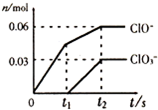 将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法不正确的是( )
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法不正确的是( )| A、苛性钾溶液中KOH的质量是16.8g |
| B、氯气在反应中既是氧化剂也是还原剂 |
| C、最终消耗氯气的物质的量为0.09mol |
| D、ClO3-的生成是由于温度升高引起的 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、图中A为CH4、B为CO2 |
| B、图中A为SO2、C为O2 |
| C、图中B为CO2、D为CH4 |
| D、图中C为CH4、D为O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙醇汽油可用普通汽油与燃料乙醇调和而成.乙醇和汽油都是可再生能源,应大力推广乙醇汽油 |
| B、区分蛋白质胶体和葡萄糖溶液可利用丁达尔效应 |
| C、奥运场馆鸟巢使用了钒氮合金高新钢,这种新型钢材的熔点、硬度均比纯铁高 |
| D、可吸入颗粒物中含有的铅、镉、铬、钒、砷等对人体有害的元素均是金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、该固体粉末中一定不含有BaCl2 |
| B、该固体粉末中一定含有KNO3 |
| C、它的组成可能是CaCO3、BaCl2 |
| D、它的组成可能是CaCO3、Na2SO4、KNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.44mol/L |
| B、3.48mol/L |
| C、0.94mol/L |
| D、1.98mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com