
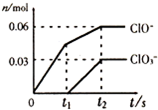
 将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法不正确的是( )
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法不正确的是( )| A、苛性钾溶液中KOH的质量是16.8g |
| B、氯气在反应中既是氧化剂也是还原剂 |
| C、最终消耗氯气的物质的量为0.09mol |
| D、ClO3-的生成是由于温度升高引起的 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| 分类标准 | 氧化物 | 电解质 | |||
| 属于该类的物质 | ② | ⑧⑨ | ⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 氢气是合成氨的重要原料,合成氨反应的热化方程式如下:
氢气是合成氨的重要原料,合成氨反应的热化方程式如下:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、单位时间内生成nmol A2,同时生成nmol AB |
| B、容器内总压强不随时间改变 |
| C、单位时间内生成2nmol AB同时生成nmol B2 |
| D、任何时间内A2、B2的物质的量之比为定值 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2:1 | B、1:2 |
| C、3:1 | D、4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cu与浓H2SO4反应放出气体:Cu+2H+═Cu2++H2↑ |
| B、稀H2SO4与BaCl2溶液反应生成沉淀:Ba2++SO42-═BaSO4↓ |
| C、用大理石与稀盐酸制备CO2:CaCO3+2H+═Ca2++CO2↑+H2O |
| D、盛放NaOH溶液的试剂瓶不能用玻璃塞:SiO2+2OH-═SiO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验室制氯气产生的尾气可用澄清石灰水吸收 |
| B、实验室可用NaOH溶液处理NO2和HCl废气 |
| C、实验室可用浓硫酸干燥氨气 |
| D、金刚石是自然界中硬度最大的物质,不可能与氧气发生反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com