
| 分类标准 | 氧化物 | 电解质 | |||
| 属于该类的物质 | ② | ⑧⑨ | ⑦ |
| 分类标准 | 金属单质 | 氧化物 | 溶液 | 胶体 | 电解质 |
| 属于该类的物质 | ③④ | ③⑤⑥⑩ |


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
| ① | |||||||||||||||||
| ② | ③ | ④ | |||||||||||||||
| ⑤ | ⑥ | ||||||||||||||||
| ⑦ | ⑧ | ⑨ | ⑩ | ||||||||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
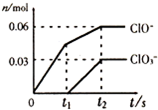 将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法不正确的是( )
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法不正确的是( )| A、苛性钾溶液中KOH的质量是16.8g |
| B、氯气在反应中既是氧化剂也是还原剂 |
| C、最终消耗氯气的物质的量为0.09mol |
| D、ClO3-的生成是由于温度升高引起的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com