
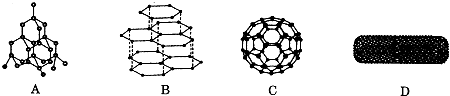
 ,
, ;
;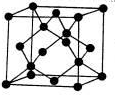 ,根据金刚石晶胞的结构图可知,金刚石晶胞是面心立方堆积完之后还在四个四面体里有原子,也就是说在金刚石晶胞的体对角线上连排了四个原子,并且相切,所以体对角线长度就是碳原子半径的8倍,设晶胞边长为a,碳原子的半径为r,即
,根据金刚石晶胞的结构图可知,金刚石晶胞是面心立方堆积完之后还在四个四面体里有原子,也就是说在金刚石晶胞的体对角线上连排了四个原子,并且相切,所以体对角线长度就是碳原子半径的8倍,设晶胞边长为a,碳原子的半径为r,即| 3 |
| 12 |
| NA |
| 1 |
| 8 |
| 1 |
| 2 |
8×
| ||
| a3 |
| 3 |
| ||
| 3 |
| ||
| 8 |
| ||
| 4 |
| 3 |
| ||
| ||
| 4 |
| 3 |
| ||


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
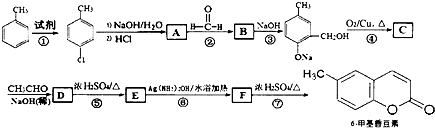
| NaOH(稀) |
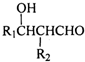 ,其中R1和R2为(烃基或H).请回答下列问题:
,其中R1和R2为(烃基或H).请回答下列问题: 结构且苯环上有2种化学环境的氢原子
结构且苯环上有2种化学环境的氢原子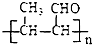 )请设计合成路线(无机试剂及溶剂任选).注:合成路线的书写格式参照如下示例流程图:CH3CHO
)请设计合成路线(无机试剂及溶剂任选).注:合成路线的书写格式参照如下示例流程图:CH3CHO| O2 |
| 催化剂/△ |
| 乙醇 |
| 浓硫酸/△ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 分类标准 | 氧化物 | 电解质 | |||
| 属于该类的物质 | ② | ⑧⑨ | ⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com