
【题目】有一铁的氧化物样品,用5 mol/ L盐酸140 mL恰好完全溶解,所得溶液还能吸收0.56 L氯气(标准状况),使其中的Fe2+全部转化为Fe3+,该样品可能的化学式为
A.Fe2O3 B.Fe3O4 C.Fe4O5 D.Fe5O7
【答案】D
【解析】
试题分析:氧化物与HCl反应生成氯化物与水,HCl中的H元素与氧化物中O元素全部结合生成H2O,由H原子、O原子守恒可知n(O)=n(H2O)=1/2n(HCl)=1/2×0.14L×5mol.L=0.35mol,所得溶液再通入氯气使其中Fe2+全部转化为Fe3+,最后溶液成分为FeCl3,根据氯原子是可知n(FeCl3) = 1/3[n(HCl) + 2n(Cl2)] = 1/3 × (0.14L × 5 mol/L + 2 × ![]() ) = 0.25 mol,所以氧化物中n(Fe):n(O)=0.25mol:0.35mol=5:7,该氧化物的化学式为Fe5O7,故选D。
) = 0.25 mol,所以氧化物中n(Fe):n(O)=0.25mol:0.35mol=5:7,该氧化物的化学式为Fe5O7,故选D。


科目:高中化学 来源: 题型:
【题目】2015年10月10日,中国首届国际山地旅游大会在黔西南州开幕,大会对推动贵州发展生态旅游有着深远的意义。生态旅游的发展需要利用环保的新能源,下列属于新能源的是( )
①天然气 ②太阳能 ③风能 ④石油 ⑤煤 ⑥生物质能 ⑦地热能 ⑧氢能
A.①②③④⑤ B.②③④⑥⑦⑧ C.①②⑤⑥⑦⑧ D.②③⑥⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )。
A. 氢原子光谱是元素的所有光谱中最复杂的光谱之一
B. “量子化”就是不连续的意思,微观粒子运动均有此特点
C. 玻尔理论不但成功解释了氢原子光谱,而且还推广到其他原子光谱
D. 原子中电子在具有确定半径的圆周轨道上像火车一样高速运转着
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把6.5 g Zn放入500mL稀盐酸中,Zn与HCl都恰好完全反应。计算:
(1)6.5 g Zn的物质的量_______________;
(2)生成的气体在标准状况下的体积_____________;
(3)原稀盐酸的物质的量浓度_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.H2SO4和H3PO4的摩尔质量相等
B.2g氢气中含有1 mol氢
C.O2的摩尔质量在数值上等于其一个分子的质量
D.1 mol CO的质量是28 g·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.一定条件下某吸热反应能自发进行,说明该反应是熵增大的反应
B.增大反应物浓度可加快反应速率,因此可用浓硫酸与铁反应增大生成H2的速率
C.催化剂可加快反应速率并影响平衡的移动
D.增大反应物固体的量可促使平衡正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学体检的血液化验单中,出现了如下图所示的体检指标。表示该体检指标的物理量是
甘油三酯 | 0.52 | mmol/L |
总胆固醇 | 4.27 | mmol/L |
高密度脂蛋白胆固醇 | 1.57 | mmol/L |
低密度脂蛋白胆固醇 | 1.40 | mmol/L |
葡萄糖 | 4.95 | mmol/L |
A.溶解度 B.物质的量浓度 C.质量分数 D.摩尔质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下表。
元索 | 相关信息 |
T | T元素可形成自然界硬度最大的单质 |
W | W与T同周期,核外有一个未成对电子 |
X | X原子的第一离能至第四电离能分别I1="578" kJ/mol; I2=" l817" kJ/mol;I3="2745" kJ/mol;I4=11575kJ/mol |
Y | 常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质 |
Z | Z的一种同位素的质量数为63,中子数为34 |
(1) TY2是一种常用的溶剂,是__________(填“极性分子”或“非极性分子”),分子中存在________个σ键。
(2)W的最简单氢化物容易液化,理由是__________,.放热419 kJ,该反应的热化学方程式为 __________。
(3)基态Y原子中,电子占据的最高能层符号为__________,该能层具有的原子轨道数为_____________、电子数为_________。Y、氧、W元素的第一电离能由大到小的顺序为_________(用元素符号作答)。
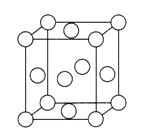
(4)已知Z的晶胞结构如图所示,又知Z的密度为9.00 g/cm3,则晶胞边长为___________cm;ZYO4常作电镀液,其中ZYO42-的空间构型是__________,其中Y原子的杂化轨道类型是___________。元素Z与人体分泌物中的盐酸以及空气反应可生成超氧酸:Z +HCl+O2=ZC1+HO2,HO2(超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列说法或表示正确的是
A.O2是氧化剂
B.HO2是氧化产物
C.HO2在碱中能稳定存在
D.1 mol Z参加反应有1 mol电子发生转移
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com