
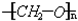 ����ͨ���Ӿ۷�Ӧ�Ƶõģ��ϳ����������ĵ�����HCHO
����ͨ���Ӿ۷�Ӧ�Ƶõģ��ϳ����������ĵ�����HCHO���� ��1����ϩ������������ʽ��ͬ��
��2�����������Ǽ�ȩ��ˮ��Һ������Ϊʯ̼�
��3����������������-OH��
��4��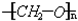 ΪHCHO�ļӾ۲��
ΪHCHO�ļӾ۲��
��5��������̼��Ʒ�Ӧ��������̼�뱽���Ʒ�Ӧ��
��6�������Ǻ�5��-OH��1��CHO�������к�6��C��12��H��6��O��
��� �⣺��1����ϩ������������ʽ��ͬ�������������ϩ��������ֱ���ȫȼ�գ�����ͬ�����������������Ĺ�ϵ����ȣ��ʴ�Ϊ����ȣ�
��2�����������Ǽ�ȩ��ˮ��Һ������Ϊʯ̼�ᣬ�ʴ�Ϊ����ȩ��ʯ̼�
��3������Ϊ����������-OH���ṹ��ʽΪCH2OHCHOHCH2OH��������ˮ���ʴ�Ϊ��CH2OHCHOHCH2OH��
��4��������������Ҫ�ijɷֵĽṹΪ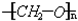 ����ͨ���Ӿ۷�Ӧ�Ƶõģ��ϳ����������ĵ�����HCHO���ʴ𰸣���HCHO��
����ͨ���Ӿ۷�Ӧ�Ƶõģ��ϳ����������ĵ�����HCHO���ʴ𰸣���HCHO��
��5��������̼��Ʒ�Ӧ��������̼�뱽���Ʒ�Ӧ����ǿ����ȡ�����֪������Ϊ���̼����ӣ��ʴ�Ϊ�����̼����ӣ�
��6�������Ǻ�5��-OH��1��CHO���ṹ��ʽΪCH2OH��CHOH��4CHO���ʴ�Ϊ��CH2OH��CHOH��4CHO��
���� ���⿼���л���Ľṹ�����ʣ�Ϊ��Ƶ���㣬���չ����������ʵĹ�ϵΪ���Ĺؼ������ط�����Ӧ�������Ŀ��飬ע�ⳣ���л�������ʣ���Ŀ�ѶȲ���


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ŵ�ʱ����������� | B�� | �ŵ�ʱOH-�������ƶ� | ||
| C�� | ˮ���������������ܼ� | D�� | �ܷ�ӦΪ��2Li+2H2O=2LiOH+H2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1�� | B�� | 2�� | C�� | 3�� | D�� | 4�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Ӧ�������������� | |
| B�� | NH4CuSO3����Ԫ�ر����� | |
| C�� | 1mol NH4CuSO3��ȫ��Ӧת��0.05mol���� | |
| D�� | �̼�����ζ��������SO2���� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com