
【题目】已知![]() 、
、![]() 是第三周期的两种金属元素,且
是第三周期的两种金属元素,且![]() 的原子半径比
的原子半径比![]() 的原子半径大,则下列叙述正确的是( )
的原子半径大,则下列叙述正确的是( )
A.![]() 的原子序数比
的原子序数比![]() 的原子序数小
的原子序数小
B.![]() 的离子比
的离子比![]() 的离子得电子能力强
的离子得电子能力强
C.![]() 的失电子能力比
的失电子能力比![]() 的失电子能力强
的失电子能力强
D.![]() 的离子半径比
的离子半径比![]() 的离子半径小
的离子半径小
【答案】C
【解析】
X、Y是第三周期的两种金属元素,且X的原子半径比Y的原子半径大,所以Y的原子序数比X的原子序数大,据此分析。
X、Y是第三周期的两种金属元素,且X的原子半径比Y的原子半径大,所以Y的原子序数比X的原子序数大;
A.由分析可知,Y的原子序数比X的原子序数大,故A错误;
B.根据同周期元素金属性的变化规律可知,X的失电子能力强于Y,则X的离子比Y的离子得电子能力弱,故B错误;
C.根据同周期元素金属性的变化规律可知,X的失电子能力强于Y,故C正确;
D.X的离子和Y的离子具有相同的电子层结构,但X的核电荷数小于Y,所以X的离子半径大于Y的离子半径,故D错误;
故答案选C。


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
【题目】一种生产聚苯乙烯的流程如下:
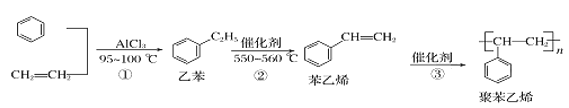
下列叙述正确的是( )
A.苯乙烯是苯的同系物
B.苯乙烯所有原子一定在同一平面内
C.反应①的反应类型是加成反应,反应②的反应类型是取代反应
D.鉴别乙苯与苯乙烯可用Br2的四氯化碳溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用NaI溶液中通入少量Cl2得到含碘废液,再利用含碘废液获取NaI固体,实验流程如下:

已知反应②:2I﹣+2Cu2++![]() +H2O
+H2O![]() 2CuI↓+
2CuI↓+![]() +2H+。
+2H+。
回答下列问题:
(1)过滤实验所需要的玻璃仪器有普通漏斗、烧杯、_____________。
(2)反应③中CuI被氧化,还原产物只有NO2,该反应的化学方程式为_________________。当有95.5 g CuI参与反应,则需要标况下______________L的O2才能将生成的NO2在水中完全转化为硝酸。
(3)化合物B中含两种元素,铁原子与另一种元素原子的物质的量之比为3∶8,则化合物B的化学式为_____________。
(4)反应⑤中生成黑色固体和无色气体,黑色固体的俗称为磁性氧化铁,则反应⑤的化学方程式为______。
(5)将足量的Cl2通入含12 g NaI的溶液中,一段时间后把溶液蒸干得到固体的质量为_________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】张亭栋研究小组受民间中医启发,发现As2O3(俗称砒霜)对白血病有明显的治疗作用。氮(N)、磷(P)、砷(As)等都是VA族的元素,该族元素的化合物在研究和生产中有许多重要用途。回答下列问题:
(1)NH3的沸点比PH3_____(填“高"或“低”),原因是_____________。
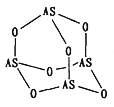
(2)Na3AsO4 中含有的化学键类型包括_______;AsO43-的空间构型为_______,As4O6的分子结构如图所示,则在该化合物中As的杂化方式是_________。
(3)自然固氮现象发生的一系列化学变化:N2→NO→NO2→HNO3→NO3-解释了民谚“雷雨发庄稼”的原理。
①NO3-中N原子采取_____杂化方式,其空间构型为________,写出它的一种等电子体的化学式________.
②已知酸性: HNO3>HNO2,下列相关见解合理的是_________.
A.含氧酸中氧原子总数越多,酸性越强
B.同种元素化合价越高,对应含氧酸的酸性越强
C.HNO3中氮元素的正电性更高,在水溶液中更易电离出H+,酸性强于HNO2
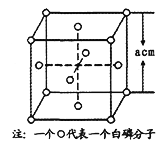
(4)白磷(P4)的晶体属于分子晶体,其晶胞结构如图(小圆圈表示白磷分子)。己知晶胞的边长为acm,阿伏加德罗常数为NA mol-1,则该晶胞中含有的P原子的个数为______,该晶体的密度为______g·cm-3(用含NA、a的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.测定化学反应速率
某同学利用如图装置测定化学反应速率。
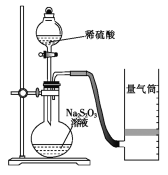
(已知:S2O32-+2H+=H2O+S↓+SO2↑)
(1)为保证实验准确性、可靠性,利用该装置进行实验前应先进行的步骤是__;除如图所示的实验用品、仪器外,还需要的一件实验仪器是__。
(2)若在2min时收集到224mL(已折算成标准状况)气体,可计算出该2min内H+的反应速率,而该测定值比实际值偏小,其原因是___。
Ⅱ.为探讨化学反应速率的影响因素
某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。已知:5H2C2O4+2KMnO4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
实验时,通过测定褪色所需时间来判断反应的快慢。限选试剂与仪器:0.20mol/LH2C2O4溶液,0.010mol/L酸性KMnO4溶液,蒸馏水,锥形瓶,恒温水浴槽,量筒,秒表。该小组设计了如下的方案。
物理量 | 水 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
体积/mL | 浓度/molL-1 | 体积/mL | 浓度/molL-1 | 体积/mL | ||
① | 0 | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
② | 0 | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
③ | 1.0 | 0.010 | 4.0 | 25 | ||
(1)已知反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4。为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为:n(H2C2O4):n(KMnO4)≥__。
(2)实验③测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=__mol·L-1·min-1。
(3)请完成表格内二处空白__、__。
(4)已知50℃时c(MnO4-)~反应时间t的变化曲线如图。其中反应速率最快的阶段是__,原因是___。
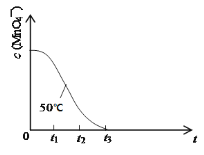
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素①~⑦在周期表中的相对位置如图所示。
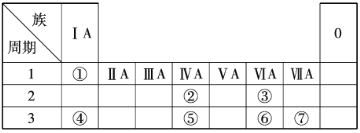
请回答下列问题。
(1)⑤的元素符号是____________,其最高正化合价是____________。
(2)①~⑦中金属性最强的是____________(填元素符号),能证明⑥比②的非金属性强的事实是____。
(3)③④形成的化合物是____________或____________。
(4)④⑥⑦原子半径由大到小的顺序是__________________(用元素符号表示);④的最高价氧化物对应的水化物是____________,它与⑥的最高价氧化物对应的水化物反应的离子方程式是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关原子核外电子及其运动状态的描述正确的是( )
①可以测定某一时刻电子所处的位置
②电子质量很小且带负电荷
③相比原子核的大小,电子运动的空间范围很大
④高速运动
⑤有固定的运动轨道
⑥电子的质量约为氢离子质量的![]()
A.①②③B.②③④⑥
C.③④⑤⑥D.⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备溴苯的反应装置如下图所示,关于实验操作或叙述错误的是

A. 向圆底烧瓶中滴加苯和溴的混合液前需先打开K
B. 实验中装置b中的液体逐渐变为浅红色
C. 装置c中的碳酸钠溶液的作用是吸收溴化氢
D. 反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.4g NaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
A.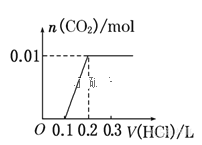 B.
B.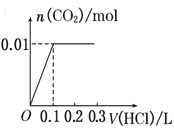
C.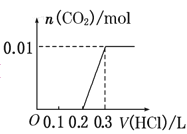 D.
D.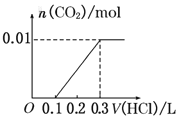
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com