
【题目】实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)
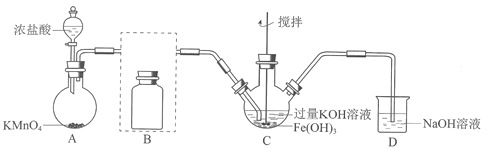
①A为氯气发生装置。A中反应方程式是________________(锰被还原为Mn2+)。
②将除杂装置B补充完整并标明所用试剂。_______
③C中得到紫色固体和溶液。C中Cl2发生的反应有
3Cl2+2Fe(OH)3+10KOH![]() 2K2FeO4+6KCl+8H2O,另外还有________________。
2K2FeO4+6KCl+8H2O,另外还有________________。
(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色。 |
方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
i.由方案Ⅰ中溶液变红可知a中含有______离子,但该离子的产生不能判断一定是K2FeO4将Cl-氧化,还可能由________________产生(用方程式表示)。
ii.方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是________________。
②根据K2FeO4的制备实验得出:氧化性Cl2________![]() (填“>”或“<”),而方案Ⅱ实验表明,Cl2和
(填“>”或“<”),而方案Ⅱ实验表明,Cl2和![]() 的氧化性强弱关系相反,原因是________________。
的氧化性强弱关系相反,原因是________________。
③资料表明,酸性溶液中的氧化性![]() >
>![]() ,验证实验如下:将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明氧化性
,验证实验如下:将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明氧化性![]() >
>![]() 。若能,请说明理由;若不能,进一步设计实验方案。
。若能,请说明理由;若不能,进一步设计实验方案。
理由或方案:________________。
【答案】 2KMnO4+16HCl![]() 2MnCl2+2KCl +5Cl2↑+8H2O
2MnCl2+2KCl +5Cl2↑+8H2O  Cl2+2OH
Cl2+2OH![]() Cl+ClO+H2O Fe3+ 4FeO42+20H+
Cl+ClO+H2O Fe3+ 4FeO42+20H+![]() 4Fe3++3O2↑+10H2O 排除ClO的干扰 > 溶液的酸碱性不同 若能,理由:FeO42在过量酸的作用下完全转化为Fe3+和O2,溶液浅紫色一定是MnO4的颜色(若不能,方案:向紫色溶液b中滴加过量稀H2SO4,观察溶液紫色快速褪去还是显浅紫色)
4Fe3++3O2↑+10H2O 排除ClO的干扰 > 溶液的酸碱性不同 若能,理由:FeO42在过量酸的作用下完全转化为Fe3+和O2,溶液浅紫色一定是MnO4的颜色(若不能,方案:向紫色溶液b中滴加过量稀H2SO4,观察溶液紫色快速褪去还是显浅紫色)
【解析】分析:(1)KMnO4与浓盐酸反应制Cl2;由于盐酸具有挥发性,所得Cl2中混有HCl和H2O(g),HCl会消耗Fe(OH)3、KOH,用饱和食盐水除去HCl;Cl2与Fe(OH)3、KOH反应制备K2FeO4;最后用NaOH溶液吸收多余Cl2,防止污染大气。
(2)①根据制备反应,C的紫色溶液中含有K2FeO4、KCl,Cl2还会与KOH反应生成KCl、KClO和H2O。
I.加入KSCN溶液,溶液变红说明a中含Fe3+。根据题意K2FeO4在酸性或中性溶液中快速产生O2,自身被还原成Fe3+。
II.产生Cl2还可能是ClO-+Cl-+2H+=Cl2↑+H2O,即KClO的存在干扰判断;K2FeO4微溶于KOH溶液,用KOH洗涤除去KClO、排除ClO-的干扰,同时保持K2FeO4稳定存在。
②根据同一反应中,氧化性:氧化剂![]() 氧化产物。对比两个反应的异同,制备反应在碱性条件下,方案II在酸性条件下,说明酸碱性的不同影响氧化性的强弱。
氧化产物。对比两个反应的异同,制备反应在碱性条件下,方案II在酸性条件下,说明酸碱性的不同影响氧化性的强弱。
③判断的依据是否排除FeO42-的颜色对实验结论的干扰。
详解:(1)①A为氯气发生装置,KMnO4与浓盐酸反应时,锰被还原为Mn2+,浓盐酸被氧化成Cl2,KMnO4与浓盐酸反应生成KCl、MnCl2、Cl2和H2O,根据得失电子守恒和原子守恒,反应的化学方程式为2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,离子方程式为2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O。
②由于盐酸具有挥发性,所得Cl2中混有HCl和H2O(g),HCl会消耗Fe(OH)3、KOH,用饱和食盐水除去HCl,除杂装置B为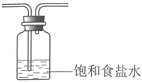 。
。
③ C中Cl2发生的反应有3Cl2+2Fe(OH)3+10KOH=2K2FeO4+6KCl+8H2O,还有Cl2与KOH的反应,Cl2与KOH反应的化学方程式为Cl2+2KOH=KCl+KClO+H2O,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O。
(2)①根据上述制备反应,C的紫色溶液中含有K2FeO4、KCl,还可能含有KClO等。
i.方案I加入KSCN溶液,溶液变红说明a中含Fe3+。但Fe3+的产生不能判断Kspan>2FeO4与Cl-发生了反应,根据题意K2FeO4在酸性或中性溶液中快速产生O2,自身被还原成Fe3+,根据得失电子守恒、原子守恒和电荷守恒,可能的反应为4FeO42-+20H+=3O2↑+4Fe3++10H2O。
ii.产生Cl2还可能是ClO-+Cl-+2H+=Cl2↑+H2O,即KClO的存在干扰判断;K2FeO4微溶于KOH溶液,用KOH溶液洗涤的目的是除去KClO、排除ClO-的干扰,同时保持K2FeO4稳定存在。
②制备K2FeO4的原理为3Cl2+2Fe(OH)3+10KOH=2K2FeO4+6KCl+8H2O,在该反应中Cl元素的化合价由0价降至-1价,Cl2是氧化剂,Fe元素的化合价由+3价升至+6价,Fe(OH)3是还原剂,K2FeO4为氧化产物,根据同一反应中,氧化性:氧化剂![]() 氧化产物,得出氧化性Cl2
氧化产物,得出氧化性Cl2![]() FeO42-;方案II的反应为2FeO42-+6Cl-+16H+=2Fe3++3Cl2↑+8H2O,实验表明,Cl2和FeO42-氧化性强弱关系相反;对比两个反应的条件,制备K2FeO4在碱性条件下,方案II在酸性条件下;说明溶液的酸碱性的不同影响物质氧化性的强弱。
FeO42-;方案II的反应为2FeO42-+6Cl-+16H+=2Fe3++3Cl2↑+8H2O,实验表明,Cl2和FeO42-氧化性强弱关系相反;对比两个反应的条件,制备K2FeO4在碱性条件下,方案II在酸性条件下;说明溶液的酸碱性的不同影响物质氧化性的强弱。
③该小题为开放性试题。若能,根据题意K2FeO4在足量H2SO4溶液中会转化为Fe3+和O2,最后溶液中不存在FeO42-,溶液振荡后呈浅紫色一定是MnO4-的颜色,说明FeO42-将Mn2+氧化成MnO4-,所以该实验方案能证明氧化性FeO42-![]() MnO4-。(或不能,因为溶液b呈紫色,溶液b滴入MnSO4和H2SO4的混合溶液中,c(FeO42-)变小,溶液的紫色也会变浅;则设计一个空白对比的实验方案,方案为:向紫色溶液b中滴加过量稀H2SO4,观察溶液紫色快速褪去还是显浅紫色)。
MnO4-。(或不能,因为溶液b呈紫色,溶液b滴入MnSO4和H2SO4的混合溶液中,c(FeO42-)变小,溶液的紫色也会变浅;则设计一个空白对比的实验方案,方案为:向紫色溶液b中滴加过量稀H2SO4,观察溶液紫色快速褪去还是显浅紫色)。


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】物质![]() 是某新型净水剂的中间体,它可以看成由AlCl3(在180℃升华)和一种盐A按物质的量之比1:2组成。在密闭容器中加热X使之完全分解,发生如下转化:
是某新型净水剂的中间体,它可以看成由AlCl3(在180℃升华)和一种盐A按物质的量之比1:2组成。在密闭容器中加热X使之完全分解,发生如下转化:
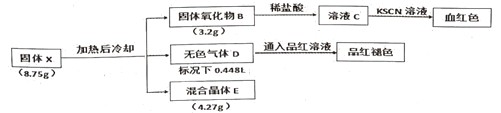
请回答下列问题:
(1)X的化学式为__。
(2)将E混合晶体溶于水配成溶液,向溶液中加入过量稀NaOH溶液时发生的总反应的离子方程式为__。
(3)高温下,若在密闭容器中长时间煅烧X,产物中还有另外一种气体,请设计实验方案验证之_。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“太阳水”电池装置如图所示,该电池由三个电极组成,其中a为TiO2电极,b为Pt电极,c为WO3电极,电解质溶液为pH=3的Li2SO4-H2SO4溶液。锂离子交换膜将电池分为A、B两个区,A区与大 气相通,B区为封闭体系并有N2保护。下列关于该电池的说法错误的是( )
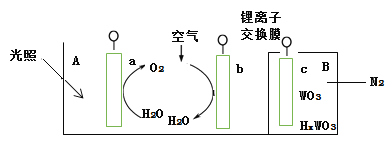
A.若用导线连接a、c,则a为负极,该电极附近pH减小
B.若用导线连接a、c,则c电极的电极反应式为HxWO3 - xe- =WO3 + xH+
C.若用导线先连接a、c,再连接b、c,可实现太阳能向电能转化
D.若用导线连接b、c, b电极的电极反应式为O2+4H++4e-=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛及其化合物在化工、医药、材料等领域有着广泛的应用。
(1)基态钛原子的价电子排布式为_____,与钛同周期的元素中,基态原子的未成对电子数与钛相同的元素分别是____(填元素符号)。
(2)在浓的TiCl 3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为TiCl3·6H2O的绿色晶体,该晶体中两种配体的物质的量之比为1∶5,则该配合物的化学式为______; 1mol该配合物中含有σ键的数目_______。
(3)半夹心结构催化剂M能催化乙烯、丙烯、苯乙烯的聚合,其结构如下图所示。
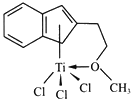
①组成M的元素中,电负性最大的是_________(填名称)。
②M中非金属元素的第一电离能大小顺序_________。
③M中不含________(填代号)。
a.π键 b.σ键 c.离子键 d.配位键
(4)金红石(TiO 2)是含钛的主要矿物之一。其晶胞是典型的四方晶系,结构(晶胞中相同位置的原子相同)如图所示。
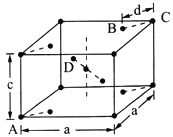
若A、B、C的原子坐标分别为A(0,0,0)、B(0.69a,0.69a,c)、C(a,a,c),则D的原子坐标为D(0.19a,____,___);钛氧键的键长d=______(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是()
A. NaCl的摩尔质量是58.5gB. 64g氧气中含有2mol氧
C. 4g氦气中含有2mol氦原子D. 0.1molCO2中含有6.02×1022个CO2分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组为了验证SO2的还原性并测定产生SO2的质量,组装了下图装置。回答下列问题:
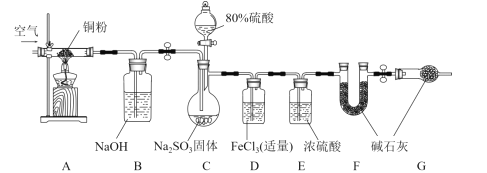
(1)C中发生反应的化学方程式是________,B装置的名称是_________,关于该套装置说法正确的是_________(填标号)。
a 组装仪器、加入药品后检查气密性 b 实验开始和最后时均需要通入空气
c 利用A、B装置是为了减小实验误差 d F、G中的碱石灰可以换为无水CaCl2
(2)甲同学认为很快可以看到D装置的现象,他的依据是_________(用离子方程式表示)。乙同学做实验时发现和甲同学预测的现象不一样,先出现棕红色,经过一段时间后变为浅绿色。于是查阅资料发现反应分为两步:
第一步:![]() (快反应)
(快反应)
第二步:![]() (慢反应)
(慢反应)
如果需要验证第一步反应是快反应,可以事先在D装置中滴加数滴_________试剂,相应的实验现象是________。
(3)学习小组通过实验后D和F装置中的数据来计算SO2的质量。D中加入足量的BaCl2溶液充分反应,经过________操作,测得沉淀为m1g,F的质量差为m2g,C中产生SO2的体积(标准状况下)为_________L。该实验的设计中,仍然存在系统误差的可能原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳的捕集、利用与封存(CCUS)是我国能源领域的一个重要战略方向。CO2可转化成有机物实现碳循环。在 2 L 的恒温恒容密闭容器中,充入 2molCO2 和 6molH2,一定条件下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g),测得 CO2 和 CH3OH(g)的浓度随时间变化如图:
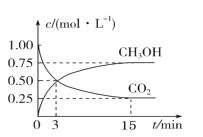
(1)从 3 min 到 15min,υ(H2)=____molL-1min-1;
(2)能说明上述反应达到平衡状态的是_____填编号)。
A. 反应中 CO2 与 CH3OH 的物质的量浓度之比为 1∶1(即图中交叉点)
B. 混合气体的压强不随时间的变化而变化
C. 单位时间内生成 1mol H2,同时生成 1mol CH3OH
D. 混合气体的平均密度不随时间的变化而变化
(3)平衡时 CO2 的转化率为 _____。
(4)平衡混合气体中 CO2(g)和 H2(g)的物质的量之比是 ______。
(5)第 3 分钟时υ正(CH3OH)______第 15 分钟时υ逆(CH3OH)(填“>”、“<” “=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,正确的是
A.已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量二氧化碳:ClO-+CO2+ H2O =HClO+HCO3-
B.硅酸钠溶液与醋酸溶液混合: SiO32-+ 2H+ = H2SiO3↓
C.从酸化的海带灰浸出液中提取碘:2I-+H2O2=I2+2OH-
D.Ca(ClO)2溶液中通入过量的SO2气体:ClO-+SO2+H2O===HClO+HSO![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com