
【题目】常温下用0.1mol/L NaOH溶液滴定40mL 0.1mol/LH2SO3溶液,所得滴定曲线如图所示(忽略混合时溶液体积的变化)。下列叙述错误的是

A.Ka2(H2SO3)的数量级为10-8
B.若滴定到第一反应终点,可用甲基橙作指示剂
C.图中Y点对应的溶液中:3c(SO32-)=c(Na+)+c(H+)-c(OH-)
D.图中Z点对应的溶液中:c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)
【答案】D
【解析】
A.据图可知c(SO32-)=c(HSO3-)时pH=7.19,Ka2(H2SO3)= c(H+)=10-7.19,则Ka2(H2SO3)的数量级为10-8,故A正确;
c(H+)=10-7.19,则Ka2(H2SO3)的数量级为10-8,故A正确;
B.甲基橙的变色范围为3.1-4.4,滴定第一反应终点pH在4.25,所以可以选取甲基橙作指示剂,溶液由红色变为橙色,故B正确;
C.Y点溶液中存在电荷守恒c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),且该点c(SO32-)=c(HSO3-),所以存在3c(SO32-)=c(Na+)+c(H+)-c(OH-),故C正确;
D.Z点溶质为Na2SO3,SO32-水解生成HSO3-,SO32-水解和水电离都生成OH-,所以c(HSO3-)<c(OH-),故D错误;
故答案为D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】孔雀石是含铜的碳酸盐矿物,主要成分为 Cu2(OH)2CO3,工业上以孔雀石(主要杂质有FeCO3、FeO、SiO2)制备胆矾的一般流程如下:
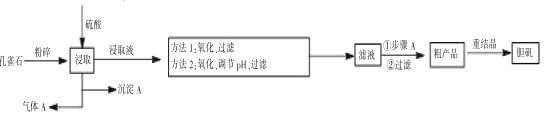
注:重结晶目的是为了除尽Fe3+
回答下列问题:
(1)写出气体A 的电子式______________。
(2)方法 1 的原理是用微酸性的高锰酸钾溶液将二价铁氧化为 Fe(OH)3,使之与 MnO2 共沉淀,易于过滤,除铁效果好,稍有过量,溶液即显微红色,便于掌握。稍过量的高锰酸钾会自动分解,产生 MnO2 和一种无毒的气体,请完善此反应的离子反应方程式:_____MnO4- +________H+ = __MnO2↓ + ____+ _____
(3)方法 1 的不足之处是在酸性条件下会发生副反应__________________ (写出离子方程式),产物Mn2+进入溶液,需要后续步骤除去,同时 Fe3+水解也不易彻底。因而实际生产中更多采用的是方法 2,用过氧化氢作为氧化剂,优点是____。氧化后调节pH 沉淀出氢氧化铁,但需注意pH 不可过高,否则造成的影响是_____。
(4)若在实验室进行步骤A 操作,需要用到的硅酸盐仪器有 _________________ 。
(5)CuSO4·5H2O 含量的测定:称取 0.5g 样品,溶于水,移入 100mL 容量瓶中,稀释至刻度,量取 25.00mL,稀释至 100mL,加入10mL 氨-氯化铵缓冲溶液(pH=10)及 0.2g 红紫酸铵混合指示剂,摇匀,用浓度为 cmol·L-1 EDTA 标准溶液滴定至溶液呈紫蓝色不变,重复三次,平均消耗的标准溶液体积为VmL。 (EDTA 能与大多数金属离子形成稳定的 1:1 络合物,是络合滴定中的常用滴定试剂)
①计算CuSO4·5H2O 质量分数 ______________。
②若不进行重结晶操作,计算出的质量分数结果会__________。(填偏低、偏高或者无影响)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制硫酸中的一步重要反应是SO2在400~600 ℃下的催化氧化:2SO2+O2![]() 2SO3,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是( )
2SO3,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是( )
A. 使用催化剂是为了加快反应速率,提高生产效率
B. 在上述条件下,SO2不可能100%地转化为SO3
C. 为了提高SO2的转化率,应适当提高O2的浓度
D. 达到平衡时,SO2的浓度与SO3的浓度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香兰素是重要的香料之一,它可由丁香油酚经多步反应合成,有关这两种化合物的说法中正确的是( )
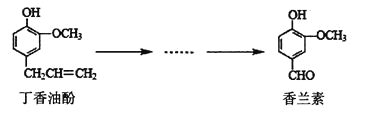
A.常温下,1mol丁香油酚只能与1molBr2反应
B.丁香油酚不能与FeCl3溶液发生显色反应
C.1mol香兰素最多能与3molH2发生加成反应
D.用酸性KMnO4溶液不能鉴别丁香油酚和香兰素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃的结构简式为![]() ,关于该有机物,下列叙述正确的是( )
,关于该有机物,下列叙述正确的是( )
A. 所有碳原子可能处于同一平面
B. 属于芳香族化合物的同分异构体有三种
C. 能发生取代反应、氧化反应和加成反应
D. 能使溴水、酸性KMnO4溶液褪色且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列四个常用电化学装置的叙述中,正确的是( )
|
|
|
|
图Ⅰ碱性锌锰电池 | 图Ⅱ铅-硫酸蓄电池 | 图Ⅲ电解精炼铜 | 图Ⅳ银锌纽扣电池 |
A.图Ⅰ所示电池中,MnO2的作用是催化剂
B.图II所示电池放电过程中,硫酸浓度不断增大
C.图III所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D.图IV所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一容积可变的密闭容器中加入WO3和H2进行反应:WO3(s)+3H2(g)![]() W(s)+3H2O(g),下列说法不正确的是( )
W(s)+3H2O(g),下列说法不正确的是( )
A.将容器的体积缩小一半,其反应速率增大
B.保持体积不变,充入氩气,其反应速率不变
C.保持压强不变,充入氖气,H2O(g)的生成速率增大
D.保持压强不变,充入氖气,H2O(g)、H2(g)的生成速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)锂空气电池比传统的锂离子电池拥有更强的蓄电能力,是传统锂离子电池容量的10倍,其工作原理示意图如图。

放电时,b电极为电源的__极,电极反应式为__。
(2)汽车尾气中CO、NO2在一定条件下可发生反应4CO(g)+2NO2(g)![]() 4CO2(g)+N2(g),一定温度下,向容积固定的2L的密闭容器中充入一定量的CO和NO2,NO2的物质的量随时间的变化曲线如图所示。
4CO2(g)+N2(g),一定温度下,向容积固定的2L的密闭容器中充入一定量的CO和NO2,NO2的物质的量随时间的变化曲线如图所示。

①0~10min内该反应的平均反应速率v(CO)=__。
②恒温恒容条件下,不能说明该反应已经达到平衡状态的是__(填序号)。
A.容器内混合气体颜色不再变化
B.容器内的压强保持不变
C.容器内混合气体密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中CO、![]() 在一定条件下可发生反应
在一定条件下可发生反应![]() ,一定温度下,向容积固定的2L的密闭容器中充入一定量的CO和
,一定温度下,向容积固定的2L的密闭容器中充入一定量的CO和![]() ,
,![]() 的物质的量随时间的变化曲线如图所示:
的物质的量随时间的变化曲线如图所示:

(1)0~10min内该反应的平均反应速率![]() ________
________
(2)恒温恒容条件下,不能说明该反应已经达到平衡状态的是________(填序号)
A.容器内混合气体颜色不再变化
B.容器内的压强保持不变
C.容器内混合气体密度保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com