
【题目】香兰素是重要的香料之一,它可由丁香油酚经多步反应合成,有关这两种化合物的说法中正确的是( )
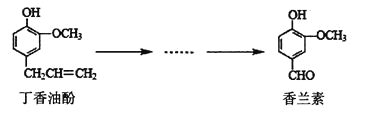
A.常温下,1mol丁香油酚只能与1molBr2反应
B.丁香油酚不能与FeCl3溶液发生显色反应
C.1mol香兰素最多能与3molH2发生加成反应
D.用酸性KMnO4溶液不能鉴别丁香油酚和香兰素
 精英口算卡系列答案
精英口算卡系列答案科目:高中化学 来源: 题型:
【题目】苯甲酸乙酯(C9H10O2)的别名为安息香酸乙酯。它是一种无色透明液体,不溶于水,有芳香气味,用于配制香水、香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等。其制备方法为: ![]() +CH3CH2OH
+CH3CH2OH![]()
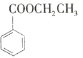 +H2O
+H2O
已知:苯甲酸在100℃会迅速升华。相关有机物的性质如表所示。
名称 | 相对分子质量 | 颜色、状态 | 沸点/℃ | 密度/(g﹒cm-3) |
苯甲酸 | 122 | 无色片状晶体 | 249 | 1.2659 |
苯甲酸乙酯 | 150 | 无色澄清液体 | 212.6 | 1.05 |
乙醇 | 46 | 无色澄清液体 | 78.3 | 0.7893 |
环己烷 | 84 | 无色澄清液体 | 80.8 | 0.7318 |
实验步骤如下:
①在圆底瓶中加入12.20g苯甲酸,25mL95%的乙醇(过量),20mL环己烷以及4mL浓硫酸,混合均匀并加入沸石,按如图所示装置装好仪器,控制温度在65~70℃加热回流2h。利用分水器不断分离除去反应生成的水,回流环己烷和乙醇。

②反应结束,打开旋塞放出分水器中的液体后,关闭旋塞,继续加热,至分水器中收集到的液体不再明显增加,停止加热。
③将烧瓶内反应液倒入盛有适量水的烧杯中,分批加入Na2CO3至溶液呈中性。用分液漏斗分出有机层,水层用25mL乙醚,静置,过滤,对滤液进行蒸馏,低温蒸出乙醚和环己烷后,继续升温,接收210~213℃的馏分。
④检验合格,测得产品体积为12.86mL。
回答下列问题:
(1)在该实验中,圆底烧瓶的容积最适合的是________(填序号)。
A. 25mL B.50mL C. 100mL D. 250mL
(2)步骤①中使用分水器不断分离除去水的目的是___________。
(3)步骤②中应控制蒸馏的温度为_______(填序号)。
A. 65~70℃ B. 78~80℃ C. 80~85℃ D. 215~220℃
(4)步骤③加入Na2CO3的作用是_______;若Na2CO3的加入量不足,在之后蒸馏时,蒸馏烧瓶中可见到白烟生成,产生该现象的原因是________。
(5)关于步骤③中的萃取分液操作的叙述正确的是__________(填序号)。
A. 水溶液中加入乙醚,转移至分液漏斗中,塞上玻璃塞,分液漏斗倒转过来,用力振摇
B. 振摇几次后需打开分液漏斗上口的玻璃塞放气
C. 经几次振摇并放气后,手持分液漏斗静置待液体分层
D. 放出液体时,应打开上口玻璃塞或将玻璃塞上的凹槽对准漏斗口上的小孔
(6)计算可得本实验的产率为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 反应CO2(g)+C(s)![]() 2CO(g)的△H<0,△S>0
2CO(g)的△H<0,△S>0
B. 钢铁水闸可用牺牲阳极或者外加电流的阴极保护法减缓其腐蚀
C. 常温下,KSP[Al(OH)3]=1×10-33。欲使溶液中c(Al3+)≤1×10-6 mol·L-1,需调节溶液的pH≥5
D. 常温常压下,11.2 L Cl2与足量铁粉充分反应,转移电子数为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光电池在光照条件下可产生电压,如下装置可以实现光能源的充分利用,双极性膜可将水解离为 H+和 OH-,并实现其定向通过。下列说法不正确的是

A.该装置将光能转化为化学能并分解水
B.双极性膜可控制其两侧溶液分别为酸性和碱性
C.光照过程中阳极区溶液中的n(OH-)基本不变
D.再生池中的反应: 2V2+ +2H2O  2V3++2OH-+H2↑
2V3++2OH-+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】页岩气中含有较多的乙烷,可将其转化为更有工业价值的乙烯。
(1) 二氧化碳氧化乙烷制乙烯。
将C2H6和CO2按物质的量之比为1∶1通入反应器中,发生如下反应:
ⅰ.C2H6(g) ![]() C2H4(g) + H2(g) ΔH1=+136.4 kJ·mol 1
C2H4(g) + H2(g) ΔH1=+136.4 kJ·mol 1
ⅱ.CO2(g) + H2(g) ![]() CO(g) + H2O(g) ΔH2=+41.2 kJ·mol 1
CO(g) + H2O(g) ΔH2=+41.2 kJ·mol 1
ⅲ.C2H6(g) +CO2(g) ![]() C2H4(g) +CO(g) +H2O(g) ΔH3
C2H4(g) +CO(g) +H2O(g) ΔH3
①用ΔH1、ΔH2计算ΔH3=______kJ·mol1。
②反应ⅳ:C2H6(g) ![]() 2C(s)+3H2(g)为积碳反应,生成的碳附着在催化剂表面, 降低催化剂的活性,适当通入过量 CO2 可以有效缓解积碳,结合方程式解释其原因:__。
2C(s)+3H2(g)为积碳反应,生成的碳附着在催化剂表面, 降低催化剂的活性,适当通入过量 CO2 可以有效缓解积碳,结合方程式解释其原因:__。
③二氧化碳氧化乙烷制乙烯的研究热点之一是选择催化剂,相同反应时间,不同温度、不同催化剂的数据如下表(均未达到平衡状态):

(注)C2H4 选择性:转化的乙烷中生成乙烯的百分比。
CO 选择性:转化的 CO2 中生成 CO 的百分比。
对比Ⅰ和Ⅱ,该反应应该选择的催化剂为__,理由是__。实验条件下,铬盐作催化剂时,随温度升高,C2H6 的转化率升高,但 C2H4 的选择性降低,原因是__。
(2) 利用质子传导型固体氧化物电解池将乙烷转化为乙烯,示意图如图:
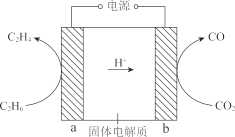
①电极 a 与电源的______极相连。
②电极 b 的电极反应式是 ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴元素由于其良好的物理化学性质,被广泛应用于生产生活中。利用含钴废料(含CoO、Co2O3、金属Al、Li等)制取CoCl2·6H2O的流程图如图所示
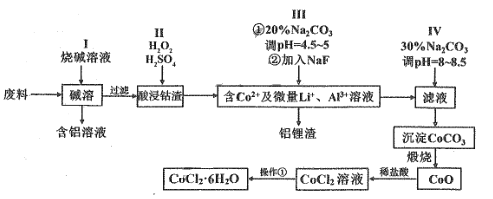
(1)写出步骤I中主要反应的化学方程式_______。
(2)步骤II中可用盐酸代替H2SO4与H2O2的混合液,但缺点是___________。
(3)步骤III①中Na2CO3溶液的作用是__________。
(4)若在实验室煅烧 CaCO3,所需硅酸盐材质的仪器除酒精灯和玻璃棒外,还有______(填仪器名称)。
(5)操作①的步骤是______、________、过滤、洗涤、干燥。洗涤过程中可以用乙醇和水的混合液代替水的优点是_______。
(6)CoCl26H2O晶体受热易分解,取119g该晶体加热至某一温度,得到CoCl2xH2O晶体83g,则x=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下用0.1mol/L NaOH溶液滴定40mL 0.1mol/LH2SO3溶液,所得滴定曲线如图所示(忽略混合时溶液体积的变化)。下列叙述错误的是

A.Ka2(H2SO3)的数量级为10-8
B.若滴定到第一反应终点,可用甲基橙作指示剂
C.图中Y点对应的溶液中:3c(SO32-)=c(Na+)+c(H+)-c(OH-)
D.图中Z点对应的溶液中:c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1是铜锌原电池示意图。图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示( )

A. 铜棒的质量 B. c(Zn2+) C. c(H+) D. c(SO42-) -
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物F(![]() )是有机合成的中间体。现以甲苯为原料合成F的路线如图所示。
)是有机合成的中间体。现以甲苯为原料合成F的路线如图所示。

已知:①R-CN![]() R-COOH
R-COOH
②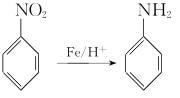
回答下列问题:
(1)A→B的反应试剂是___。
(2)B→C反应的化学方程式为___,反应类型是___。D→E的反应类型是___。
(3)D中含氧官能团的名称是___。
(4)G是F的同系物,比F多一个碳原子,其苯环上含两个取代基的同分异构体有___种(不考虑立体异构)。其中核磁共振氢谱有六组峰,且峰面积之比为1:1:1:2:2:3的有机物结构简式为___。
(5)结合以上合成路线及相关信息,设计由苯合成苯酚的合成路线___。(用合成流程图表示,并注明反应条件)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com