
【题目】图1是铜锌原电池示意图。图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示( )

A. 铜棒的质量 B. c(Zn2+) C. c(H+) D. c(SO42-) -
科目:高中化学 来源: 题型:
【题目】下列电离方程式书写正确的是
A. NaHCO3![]() Na+ + HCO3-
Na+ + HCO3-
B. CaCO3 = Ca2+ + CO32-
C. Cu(NO3)2 = Cu2+ + (NO3-)2
D. HClO = H+ + ClO-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(12分) 为测定NaOH、Na2C03混合物中Na2C03的质量分数,甲同学拟采用图(1)
所示装置来测定。乙同学拟采用图(2)所示装置来测定。
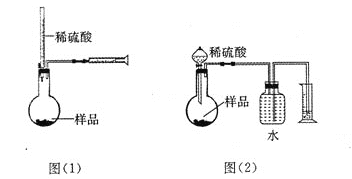
请回答下列问题:
(1)甲同学用图(1)装置来测定,在没有放样品前,检查该装置气密性的方法之一是从酸式滴定管向烧瓶中加入一定量的水,观察到 现象,证明此装量不漏气。实验时称得样品的质量为mg,酸式滴定管的起始读数为amL,终了读数为bmL,注射器测定排出的气体为c mL(已折算成标准状况),该样品中Na2C03的质量分数为(用含a、b、c、m的代数式表示)____ 。
(2)本实验选用稀H2S04而未选用稀盐酸的原因是 。
(3)乙同学观察了甲同学的实验后很受启发,并发现自己的图(2)原实验设计方案会造成误差.其原因之一可能是C02在水中溶解度较大,引起测量气体体积减小。
丙同学经思考后。建议乙同学将图(2)中某部分稍作改进,就可避免此种误差,写出你的改进方案 。
(4)丁同学提出将图(2)装置中量气装置去掉,只用反应装置和天平也能较准确地测出样品中Na2C03的质量分数,请你分析丁同学方案中,除了测定样品的质量,还需测定的另两个数据是 、 。
(5)还可以用其他实验方法测定试样中纯碱的质量分数,请简述一种与上述各方法不同的实验方法 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组拟用下图装置制备氢氧化亚铁并观察其颜色。提供化学药品:铁粉、稀硫酸、氢氧化钠溶液。
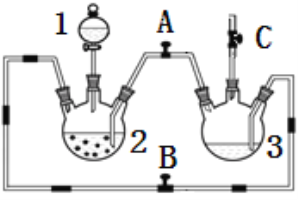
(1)稀硫酸应放在___________中(填写仪器名称).
(2)本实验通过控制A、B、C三个开关,将仪器中的空气排尽后,再关闭开关______、打开开关_______就可观察到氢氧化亚铁的颜色。试分析实验开始时排尽装置中空气的理由_________________.
(3)该实验使用铁粉,除反应速率可能太快外,还可能会造成的不良后果是__________________.
(4)在FeSO4溶液中加入(NH4)2SO4固体可制备硫酸亚铁铵晶体[(NH4)2SO4·FeSO4·6H2O] (式量为392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇。
①为洗涤(NH4)2SO4·FeSO4·6H2O粗产品,下列方法中最合适的是__________。
A.用冷水洗 B.先用冷水洗,后用无水乙醇洗
C.用30%的乙醇溶液洗 D.用90%的乙醇溶液洗
②为了测定产品的纯度,称取a g产品溶于水,配制成500mL溶液,用浓度为c mol·L-1的酸性KMnO4溶液滴定。每次所取待测液体积均为25.00mL,实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
滴定过程中发生反应的离子方程式为______________________.滴定终点的现象是_____________________.通过实验数据计算的该产品纯度为______________(用字母ac表).上表中第一次实验中记录数据明显大于后两次,其原因可能是_______。
A.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
D.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:5KI+KIO3+3H2O=3I2+6KOH。其中,还原剂是____________(填化学式)。若反应中消耗1molKIO3,则生成I2____________mol,转移电子的物质的量为____________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向50 mL 18 mol·L-1的H2SO4溶液中加入适量的铜片并加热。充分反应后,被还原的H2SO4的物质的量( )
A. 小于0.45 mol B. 等于0.45 mol
C. 在0.45~0.90 mol之间 D. 大于0.45 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.淀粉和纤维素水解最终产物都是葡萄糖B.油脂水解可得到氨基酸和甘油
C.蛋白质水解的最终产物是多肽D.蔗糖在人体内水解产物只有葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中属于氧化还原反应,但水既不作氧化剂又不作还原剂的是( )
A.SO3+H2O=H2SO4
B.2Na2O2+2H2O=4NaOH+O2↑
C.2F2+2H2O=4HF+O2
D.2Na+2H2O=2NaOH+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制胆矾时,将粗制CuO粉末(含杂质FeO、Fe2O3)慢慢加入适量的稀H2SO4中完全溶解后,除去杂质离子后,再蒸发结晶可得纯净的胆矾晶体。已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH在3~4时,Fe3+以Fe(OH)3的形式完全沉淀.回答下列问题:
(1)为除去溶液中的Fe2+,可先加入______(填化学式)将Fe2+氧化为Fe3+,反应的离子方程式为__________,然后再加入适量的__________调整溶液的pH到______,使Fe3+转化为Fe(OH)3。
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=1×10-38,Cu(OH)2的溶度积Ksp=3×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 molL-1时就认为沉淀完全,设溶液中CuSO4的浓度为3molL-1,则Cu(OH)2开始沉淀时溶液的pH为______,Fe3+完全沉淀时溶液的pH为______,通过计算确定上述方案______ (填“可行”或“不可行”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com