
【题目】下列反应中属于氧化还原反应,但水既不作氧化剂又不作还原剂的是( )
A.SO3+H2O=H2SO4
B.2Na2O2+2H2O=4NaOH+O2↑
C.2F2+2H2O=4HF+O2
D.2Na+2H2O=2NaOH+H2↑
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
【题目】环境监测测定水中溶解氧的方法是:
①量取a mL水样,迅速加入固定剂MnSO4溶液和碱性KI溶液(含KOH),立即塞好瓶塞,反复振荡,使之充分反应,其反应式为:2Mn2++O2+4OH-===2MnO(OH)2(该反应极快)。
②测定:开塞后迅速加入1~2 mL浓硫酸(酸化,提供H+),使之生成I2,再用b mol/L的Na2S2O3溶液滴定(以淀粉为指示剂),消耗V mL。有关反应式为:MnO(OH)2+2I-+4H+===Mn2++I2+3H2O、I2+2S2O![]() ===2I-+S4O
===2I-+S4O![]() 。
。
试回答:
(1)滴定过程中用到的玻璃仪器除了酸式滴定管、碱式滴定管外还缺少_____________。
(2)滴定操作时,左手控制滴定管,右手________,眼睛要注视________。
(3)水中溶解氧的计算式是______(以g/L为单位)。
(4)滴定(I2和S2O![]() 反应)以淀粉为指示剂,终点时溶液由________色变为________色,且半分钟内不褪色。
反应)以淀粉为指示剂,终点时溶液由________色变为________色,且半分钟内不褪色。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1是铜锌原电池示意图。图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示( )

A. 铜棒的质量 B. c(Zn2+) C. c(H+) D. c(SO42-) -
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向10mL0.1mol/L二元弱酸H2A溶液中滴加0.1mol/LNaOH溶液,溶液中各组分物质的量分数δ(X) [δ(X)=![]() ]随pH的变化如图所示。下列叙述错误的是
]随pH的变化如图所示。下列叙述错误的是
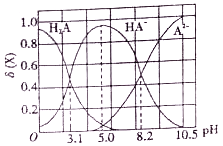
A. Ka1(H2A)为10-3.1
B. pH=5.0时,c(Na+)>c(HA-)>c(H+)>c(OH-)>c(A2-)
C. pH=8.2时,c(Na+)+c(H+)=c(OH-)+3c(A2-)
D. pH由5.0调至10.5时,主要反应的离子方程式为HA-+OH-=A2-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以某废催化剂(含Al2O3 36%、CoS 20%、MoS2 20%、MgO 8%等)为原料生产Co2O3的工艺路线如下:
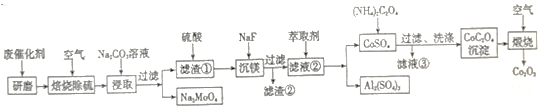
已知: 氧化铝有两种晶型α-Al2O3 和γ- Al2O3,α- Al2O3致密难溶于酸和碱。
(1)废催化剂焙烧前先将其研磨,其目的是_________________________。
(2)已知“焙烧除硫”后的产物有CoO、MoO3。写出Na2CO3溶液“浸取”过程的离子反应方程式:______________________。
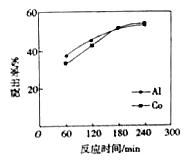
(3) 硫酸浸泡滤渣①的实验条件为硫酸浓度12 mol/L、液固比为3、反应温度60℃。该条件下,铝、钴浸出率与时间关系如图。当浸泡时间小于180 min时,铝、钴浸出率随着时间的推移均增加较快;180 min 后铝和钴的浸出率都提高不多,且钴浸出率高于铝浸出率。试解释180min后钴浸出率高于铝浸出率的原因: ____________________。
(4)萃取剂对Al3+、Co2+萃取率与pH 的关系如图。
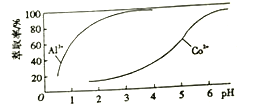
萃取分离钴、铝的实验操作为: 向萃取分液后的有机相中加硫酸调pH=3~4,分液可得CoSO4溶液,___________,可得Al2(SO4)3溶液。
(5)“滤液③”主要物质的化学成分是_______ (写化学式),用途之一为___________________。
(6)“煅烧”过程 相关反应的化学方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸普鲁卡因[H2N![]() COOCH2CH2N+H(C2H5)2·Cl-]是一种麻醉药,可由乙烯和苯合成。流程如下:
COOCH2CH2N+H(C2H5)2·Cl-]是一种麻醉药,可由乙烯和苯合成。流程如下:
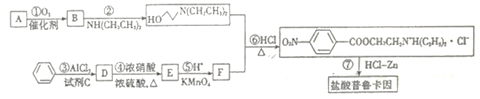
已知: I.B核磁共振氢谱只有1组峰; D的相对分子质量为92。
II.试剂C 是一氯代烃,与苯的反应为: ![]()
回答下列问题:
(1)F的结构简式为______________,它含有的官能团名称是_____________________。
(2)反应④的反应类型为______反应,其化学方程式:___________________________。
(3)反应③的化学方程式为______________________________________。
(4)E的既能发生银镜反应,又能遇FeCl3溶液显色且不含酰胺键的芳香族同分异构体有____种,任写其一种结构简式:________________________________。
(5)参照上述合成路线,设计由甲苯合成对氨基苯甲酸(H2N![]() COOH)的合成路线(其他无机试剂任选)_____________。
COOH)的合成路线(其他无机试剂任选)_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列分子或离子在酸性条件下都能氧化KI,自身发生如下变化:
H2O2→H2O IO3-→I2 MnO4-→Mn2+ HNO2→NO
如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是( )
A.H2O2
B.IO3-
C.MnO4-
D.HNO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的反应,属于同一反应类型的是( )
A.由溴丙烷水解制丙醇;由丙烯与水反应制丙醇
B.由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸
C.由乙酸和乙醇制乙酸乙酯;由苯甲酸乙酯水解制苯甲酸和乙醇
D.由氯代环己烷消去制环己烯;由丙烯加溴制1,2-二溴丙烷
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com