
【题目】已知下列分子或离子在酸性条件下都能氧化KI,自身发生如下变化:
H2O2→H2O IO3-→I2 MnO4-→Mn2+ HNO2→NO
如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是( )
A.H2O2
B.IO3-
C.MnO4-
D.HNO2
 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源: 题型:
【题目】某化学兴趣小组拟用下图装置制备氢氧化亚铁并观察其颜色。提供化学药品:铁粉、稀硫酸、氢氧化钠溶液。
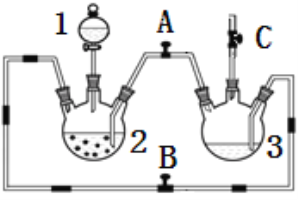
(1)稀硫酸应放在___________中(填写仪器名称).
(2)本实验通过控制A、B、C三个开关,将仪器中的空气排尽后,再关闭开关______、打开开关_______就可观察到氢氧化亚铁的颜色。试分析实验开始时排尽装置中空气的理由_________________.
(3)该实验使用铁粉,除反应速率可能太快外,还可能会造成的不良后果是__________________.
(4)在FeSO4溶液中加入(NH4)2SO4固体可制备硫酸亚铁铵晶体[(NH4)2SO4·FeSO4·6H2O] (式量为392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇。
①为洗涤(NH4)2SO4·FeSO4·6H2O粗产品,下列方法中最合适的是__________。
A.用冷水洗 B.先用冷水洗,后用无水乙醇洗
C.用30%的乙醇溶液洗 D.用90%的乙醇溶液洗
②为了测定产品的纯度,称取a g产品溶于水,配制成500mL溶液,用浓度为c mol·L-1的酸性KMnO4溶液滴定。每次所取待测液体积均为25.00mL,实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
滴定过程中发生反应的离子方程式为______________________.滴定终点的现象是_____________________.通过实验数据计算的该产品纯度为______________(用字母ac表).上表中第一次实验中记录数据明显大于后两次,其原因可能是_______。
A.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
D.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中属于氧化还原反应,但水既不作氧化剂又不作还原剂的是( )
A.SO3+H2O=H2SO4
B.2Na2O2+2H2O=4NaOH+O2↑
C.2F2+2H2O=4HF+O2
D.2Na+2H2O=2NaOH+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石墨作电极电解100mLAgNO3溶液,通电一段时间后,两极均收集到2.24 L气体(标准状况),则原AgNO3溶液的物质的量浓度为( )
A. 3mol·L-1 B. 2mol·L-1 C. 1.5mol·L-1 D. 1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某工业废水中含有大量FeSO4,较多的Cu2+, 以及部分污泥,通过下列流程可从该废水中回收FeSO4·7H2O晶体及金属Cu。

(1)步骤1的主要操作是___________,(填操作名称)需用到的玻璃仪器除烧杯外还有___________, ___________。
(2)步骤2中发生反应的离子方程式为______________________________
(3)步骤3中发生反应的化学方程式为______________________________
(4)步骤4中涉及的操作是:蒸发浓缩、________、过滤、洗涤、烘干。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制备乙炔的电石渣对环境污染极为严重,因此需要对水体进行净化处理。现取500mL电石渣废水(阳离子主要为Ca2+),测定水质的数据如下表所示。

注:SS表示固体悬浮物
模拟工业处理流程如下:
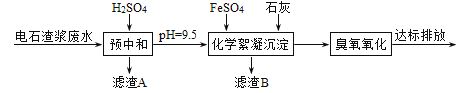
已知:i.常温时CaSO4微溶于水; ii.溶解度: CaSO4>Fe(OH)2>FeS。
(1)①采用20%的硫酸对废水进行预中和处理,pH变化如下图所示。硫酸的用量和废水中固体悬浮物(SS)含量的关系是_______。

②废水中SS含量随时间变化如下表所示。
静置时间(h) | 1 | 2 | 3 | 4 | 5 | 6 | 24 |
SS含量(mg/L) | 2500 | 1800 | 1300 | 900 | 820 | 800 | 780 |
为降低成本,减少硫酸投加量的最好办法是_______。
③滤渣A的主要成分有SS和_______。
(2)根据表中数据,回答下列问题。

①化学絮凝沉淀过程中,加入FeSO4发生反应的离子方程式是______。
②熟石灰能促进沉淀的生成,结合离子方程式,从平衡角度分析其原因是_______。
(3)用臭氧进一步处理废水中的氰化物和残留硫化物,若将500mL废水中的CN-完全氧化成N2和CO2,转移______mol e-。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制胆矾时,将粗制CuO粉末(含杂质FeO、Fe2O3)慢慢加入适量的稀H2SO4中完全溶解后,除去杂质离子后,再蒸发结晶可得纯净的胆矾晶体。已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH在3~4时,Fe3+以Fe(OH)3的形式完全沉淀.回答下列问题:
(1)为除去溶液中的Fe2+,可先加入______(填化学式)将Fe2+氧化为Fe3+,反应的离子方程式为__________,然后再加入适量的__________调整溶液的pH到______,使Fe3+转化为Fe(OH)3。
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=1×10-38,Cu(OH)2的溶度积Ksp=3×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 molL-1时就认为沉淀完全,设溶液中CuSO4的浓度为3molL-1,则Cu(OH)2开始沉淀时溶液的pH为______,Fe3+完全沉淀时溶液的pH为______,通过计算确定上述方案______ (填“可行”或“不可行”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,水溶液中H+的浓度变化曲线如图所示,下列说法正确的是( )

A. 该温度下,加入FeCl3可能引起由b向a的变化
B. 该温度下,水的离子积常数为1.0×10-13
C. 升高温度,可能引起由c向b的变化
D. 该温度下,稀释溶液可能引起由c向d的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①2K2CrO4+H2SO4![]() K2Cr2O7+K2SO4+H2O
K2Cr2O7+K2SO4+H2O
②K2Cr2O7+6FeSO4+7H2SO4![]() 3Fe2(SO4)3+ Cr2(SO4)3 +K2SO4+7H2O
3Fe2(SO4)3+ Cr2(SO4)3 +K2SO4+7H2O
③Fe2(SO4)3+2HI![]() 2FeSO4+I2+H2SO4
2FeSO4+I2+H2SO4
下列结论正确的是
A. ①②③均是氧化还原反应
B. 氧化性强弱顺序是K2Cr2O7>Fe2(SO4)3>I2
C. 反应②中氧化剂与还原剂的物质的量之比为6∶1
D. 反应③中0.1 mol还原剂共失去电子数为6.02×1023
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com