
����Ŀ���Ʊ���Ȳ�ĵ�ʯ���Ի�����Ⱦ��Ϊ���أ������Ҫ��ˮ����о�����������ȡ500mL��ʯ����ˮ(��������ҪΪCa2+)���ⶨˮ�ʵ��������±���ʾ��

ע��SS��ʾ����������
ģ�ҵ�����������£�
��֪��i������ʱCaSO4����ˮ�� ii���ܽ�ȣ� CaSO4>Fe(OH)2>FeS��
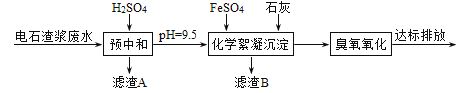
��1���ٲ���20%������Է�ˮ����Ԥ�кʹ�����pH�仯����ͼ��ʾ������������ͷ�ˮ�й���������(SS)�����Ĺ�ϵ��_______��

�ڷ�ˮ��SS������ʱ��仯���±���ʾ��
����ʱ��(h) | 1 | 2 | 3 | 4 | 5 | 6 | 24 |
SS����(mg/L) | 2500 | 1800 | 1300 | 900 | 820 | 800 | 780 |
Ϊ���ͳɱ�����������Ͷ��������ð취��_______��
������A����Ҫ�ɷ���SS��_______��
��2�����ݱ������ݣ��ش��������⡣

�ٻ�ѧ�������������У�����FeSO4������Ӧ�����ӷ���ʽ��______��
����ʯ���ܴٽ����������ɣ�������ӷ���ʽ����ƽ��Ƕȷ�����ԭ����_______��
��3���ó�����һ��������ˮ�е��軯��Ͳ����������500mL��ˮ�е�CN-��ȫ������N2��CO2��ת��______mol e-��
���𰸡� ��������ͬ pHʱ����ˮ��SS����Խ�ߣ��к����������Խ�� ������ǰ������5~6Сʱ CaSO4 Fe2++S2��= FeS ˮ��ƽ�⣺S2�� +H2O![]() HS�� +OH����������ʯ�ң�c(OH��)����ƽ�������ƶ���c(S2��)����������FeS���������� 5��10-4
HS�� +OH����������ʯ�ң�c(OH��)����ƽ�������ƶ���c(S2��)����������FeS���������� 5��10-4
��������(1)�ٸ�������������ͷ�ˮ�й���������(SS)�����Ĺ�ϵͼ���֪����������ͬ pHʱ����ˮ��SS����Խ�ߣ��к����������Խ�࣬�ʴ�Ϊ����������ͬ pHʱ����ˮ��SS����Խ�ߣ��к����������Խ����
�ڸ��ݷ�ˮ��SS������ʱ��仯���ݿ�֪������ʱ��Խ����SS����ԽС���������ݣ�����5~6Сʱ��SS�����仯��С��Ϊ���ͳɱ�����������Ͷ��������ð취�Ǽ�����ǰ������5~6Сʱ���ʴ�Ϊ��������ǰ������5~6Сʱ��
�۵�ʯ����ˮ�е���������ҪΪCa2+���ܹ������ᷴӦ����CaSO4�������������A����Ҫ�ɷ���SS��CaSO4���ʴ�Ϊ��CaSO4��
(2)�ٸ��ݱ������ݣ���ѧ�������������У�����FeSO4��Ҫ���ˮ�е������ӷ�Ӧ������������������Ӧ�����ӷ���ʽΪFe2++S2��= FeS���ʴ�Ϊ��Fe2++S2��= FeS��
���������ܹ�ˮ�⣬��Һ�Լ��ԣ�������ʯ����Һ�ļ�����ǿ��������ˮ�⣬������FeS���������ɣ��ʴ�Ϊ��S2�� +H2O![]() HS�� +OH����������ʯ�ң�c(OH��)����ƽ�������ƶ���c(S2��)����������FeS������������
HS�� +OH����������ʯ�ң�c(OH��)����ƽ�������ƶ���c(S2��)����������FeS������������
(3)500mL��ˮ�к���CN-�����ʵ���Ϊ![]() =0.0001mol������0.0001molCO2��0.00005molN2��ת�Ƶĵ��ӵ����ʵ���Ϊ0.0001mol��(4-2)+0.00005mol��2��(3-0)=5��10-4 mol���ʴ�Ϊ��5��10-4��
=0.0001mol������0.0001molCO2��0.00005molN2��ת�Ƶĵ��ӵ����ʵ���Ϊ0.0001mol��(4-2)+0.00005mol��2��(3-0)=5��10-4 mol���ʴ�Ϊ��5��10-4��


 ������ÿ�ʱ��ҵϵ�д�
������ÿ�ʱ��ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��д��ȷ����
A. �ƺ���ˮ��Ӧ��Na��2H2O��Na+��2OH��H2��
B. ����ʯ��ˮ������NaHCO3��Һ��ϣ�Ca2+ + OH��+ HCO3��![]() CaCO3��+ H2O
CaCO3��+ H2O
C. ���ˮ�е��������ı����Ȼ�����Һ��Fe 3++3H2O![]() Fe(OH)3��+3H+
Fe(OH)3��+3H+
D. ̼�������Һ�м����������������Һ HCO3��+ OH����CO32��+ H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij�ϴ���(��Al2O3 36%��CoS 20%��MoS2 20%��MgO 8%��)Ϊԭ������Co2O3�Ĺ���·������:
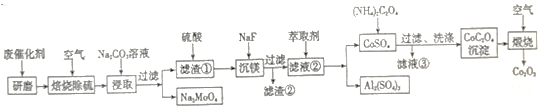
��֪: �����������־�����-Al2O3 ����- Al2O3����- Al2O3������������ͼ
(1)�ϴ�������ǰ�Ƚ�����ĥ����Ŀ����_________________________��
(2)��֪�����ճ�������IJ�����CoO��MoO3��д��Na2CO3��Һ����ȡ�����̵����ӷ�Ӧ����ʽ:______________________��
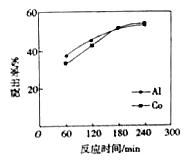
(3) ������������ٵ�ʵ������Ϊ����Ũ��12 mol/L��Һ�̱�Ϊ3����Ӧ�¶�60�档�������£������ܽ�������ʱ���ϵ��ͼ��������ʱ��С��180 minʱ�������ܽ���������ʱ������ƾ����ӽϿ죻180 min �������ܵĽ����ʶ���߲��࣬���ܽ����ʸ����������ʡ��Խ���180min���ܽ����ʸ����������ʵ�ԭ��: ____________________��
(4)��ȡ����Al3+��Co2+��ȡ����pH �Ĺ�ϵ��ͼ��
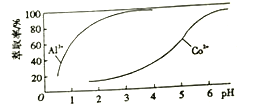
��ȡ�����ܡ�����ʵ�����Ϊ: ����ȡ��Һ����л����м������pH=3~4����Һ�ɵ�CoSO4��Һ��___________���ɵ�Al2(SO4)3��Һ��
(5)����Һ������Ҫ���ʵĻ�ѧ�ɷ���_______ (д��ѧʽ)����;֮һΪ___________________��
(6)������������ ��ط�Ӧ�Ļ�ѧ����ʽΪ_________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ơ�ʳ�ס����ǵȾ�Ϊ��ͥ�����г��õ����ʣ�������Щ�������������ʵ�����
����֤�����ܷ�������ڼ�������Ƿ��м״��ۼ���ʳ�κ�С�մ�ܼ�������ˮ���Ƿ���������
A.�٢�B.�ڢ�C.�ۢ�D.�٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���з��ӻ����������������¶�������KI�������������±仯��
H2O2��H2O IO3����I2 MnO4����Mn2�� HNO2��NO
����ֱ��õ����ʵ�������Щ��������������KI���õ�I2������( )
A.H2O2
B.IO3��
C.MnO4��
D.HNO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ȤС�����õ��װ�ã�̽��������������ʱ������Ӧ�Ķ����ԣ�ʵ��������¡�
I.KCl�������
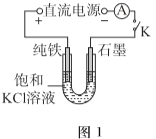
��1��һ����ѹ�£���ͼ-1װ�õ�⣬�������£�
ʯī�缫��Ѹ�ٲ�����ɫ���壬���缫�����������ɣ������ܽ⡣
5min��U���²����ֻ���ɫ���壬֮�����缫����Ҳ���ֻ���ɫ���壬10min��Ͽ�K����ͼ-2����ʵ�顣
��ʯī�缫�ϵĵ缫��Ӧʽ��________��
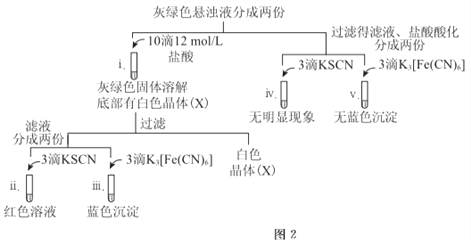
��ȷ�ϻ���ɫ�����к���Fe2+��ʵ��������_______��
�����վ���X������ɫ�ܲ����۲쵽�������ɫ�����ƽ���ƶ�ԭ�������͡��Թ�i��������ɫ���塱��ԭ����_______��
��2��������������ʱ����ͼ-3װ���ظ�ʵ�飬10min�����缫������Һ��Ȼ���壬�Ͽ�K����ͼ-4����ʵ��
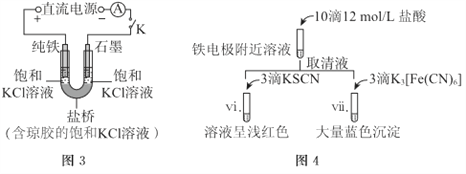
�����ŵ�������_______��
����ʵ��I��vi��vii��ii~v�е�����Ƚϣ����Եó��Ľ����ǣ������㣩��_______��
II.KOH�������
��3����ͼ-1װ�õ��ŨKOH��Һ���۲쵽���缫���������������ɣ�������Һ��Ϊ����ɫ��![]() ����û�г���������
����û�г���������
�����缫��OH-�ܹ��ŵ��ԭ����______��
����������![]() ���ܵ缫��Ӧʽ��______��
���ܵ缫��Ӧʽ��______��
��ijͬѧ�Ʋ�����![]() �ı�Ҫ������Ũ�������ͼ-5�е�ʵ�鷽������������֤ʵ�Ʋ������
�ı�Ҫ������Ũ�������ͼ-5�е�ʵ�鷽������������֤ʵ�Ʋ������
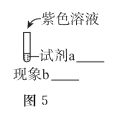 ______
______
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��д����ȷ����
A��������ͭƬ���缫������Cu + 2H+ ![]() H2�� + Cu2+
H2�� + Cu2+
B��NaOH��Һ��������Ca(HCO3)2��Һ��Ӧ��2HCO3- + 2OH- + Ca2+==CaCO3��+ 2H2O
C�������ʵ�����FeBr2��Cl2����Һ�еķ�Ӧ��2Fe2+ + 2Br - + 2Cl2==2Fe3+ + Br2 + 4Cl -
D����ˮ���������Ķ���������2NH3��H2O + SO2==2NH4+ +SO32- + H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2 g Cu2S��CuS�Ļ������������Һ����400 mL 0.075 mol��L��1 KMnO4��Һ������������Ӧ���£�
![]() ��5Cu2S��44H��= 10Cu2����5SO2����8Mn2����22H2O
��5Cu2S��44H��= 10Cu2����5SO2����8Mn2����22H2O
![]() ��5CuS��28H�� = 5Cu2����5SO2����6Mn2����14H2O
��5CuS��28H�� = 5Cu2����5SO2����6Mn2����14H2O
��Ӧ�������Һ���Ͼ�SO2��ʣ���KMnO4ǡ����350 mL 0.1 mol��L��1��NH4��2Fe��SO4��2��Һ��ȫ��Ӧ����1����ƽKMnO4����NH4��2Fe��SO4��2��Ӧ�����ӷ���ʽ
______![]() ��______Fe2����______H�� =______Mn2����______Fe3����______H2O
��______Fe2����______H�� =______Mn2����______Fe3����______H2O
��2��KMnO4��Һ�����ﷴӦ����ʣ��KMnO4�����ʵ���Ϊ________mol��
��3���������Cu2S����������Ϊ_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ˮ��Ҫ��Դ���ȼҵ�����Ϲ�ҵ��δ�����������ŷš�ij�������Է�ˮ����Ҫ��Hg2+��H+��Na+��Cl-�ȣ��Ĵ���������������ͼ��ʾ��

��ش�
��1��������ˮδ������ֱ���ŷŵ�Σ����_________������ĸ��
a.���ˮ����Ⱦ b. ���������ж�
��2������pHʱ�������ҺA������__________������ĸ��
a. ���� b. NaOH��Һ
��3��ͼʾ���õ��ķ�ˮ��������Ϊ_____________������Na2S��Hg2+������Ӧ�����ӷ���ʽΪ________________________________________��
��4���÷�ˮ����������й��������£��������Ӻ��Բ��ƣ���
���� | Na+ | Fe2+ | Cl- | SO42- |
Ũ��(mol/L) | 3.0��10-4 | c | 2.0��10-4 | 2.5��10-4 |
��c(Fe2+) = ______________mol/L��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com