
【题目】含汞废水主要来源于氯碱工业和塑料工业,未经处理不得排放。某含汞酸性废水(主要含Hg2+、H+、Na+、Cl-等)的处理工艺流程如下图所示:

请回答:
(1)含汞废水未经处理直接排放的危害是_________(填字母)
a.造成水体污染 b. 引起人体中毒
(2)调节pH时加入的溶液A可能是__________(填字母)
a. 盐酸 b. NaOH溶液
(3)图示所用到的废水处理方法为_____________,其中Na2S与Hg2+发生反应的离子方程式为________________________________________。
(4)该废水经处理后,测得有关数据如下(其他离子忽略不计):
离子 | Na+ | Fe2+ | Cl- | SO42- |
浓度(mol/L) | 3.0×10-4 | c | 2.0×10-4 | 2.5×10-4 |
则c(Fe2+) = ______________mol/L。
【答案】 ab b 沉淀法 S2- + Hg2+ = HgS↓ 2.0×10-4
【解析】(1)汞是重金属,其离子可以使蛋白质变性,所以是有毒离子,含汞的废水未经处理直接排放,会造成水体的污染,同时也可能引起人体中毒。所以选项a、选项b正确。
(2)调节pH的时候应该是将酸性溶液调成碱性,所以只可能是氢氧化钠,选项B正确。
(3)这种将有害离子转化为沉淀除去的方法叫沉淀法。其中Na2S与Hg2+发生反应的离子方程式为:S2- + Hg2+ = HgS↓ 。
(4)根据电荷守恒,得到:3.0×10-4 + 2c = 2×10-4 + 2×2.5×10-4 ,所以c(Fe2+) = 2.0×10-4mol/L。


科目:高中化学 来源: 题型:
【题目】制备乙炔的电石渣对环境污染极为严重,因此需要对水体进行净化处理。现取500mL电石渣废水(阳离子主要为Ca2+),测定水质的数据如下表所示。

注:SS表示固体悬浮物
模拟工业处理流程如下:
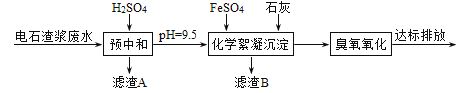
已知:i.常温时CaSO4微溶于水; ii.溶解度: CaSO4>Fe(OH)2>FeS。
(1)①采用20%的硫酸对废水进行预中和处理,pH变化如下图所示。硫酸的用量和废水中固体悬浮物(SS)含量的关系是_______。

②废水中SS含量随时间变化如下表所示。
静置时间(h) | 1 | 2 | 3 | 4 | 5 | 6 | 24 |
SS含量(mg/L) | 2500 | 1800 | 1300 | 900 | 820 | 800 | 780 |
为降低成本,减少硫酸投加量的最好办法是_______。
③滤渣A的主要成分有SS和_______。
(2)根据表中数据,回答下列问题。

①化学絮凝沉淀过程中,加入FeSO4发生反应的离子方程式是______。
②熟石灰能促进沉淀的生成,结合离子方程式,从平衡角度分析其原因是_______。
(3)用臭氧进一步处理废水中的氰化物和残留硫化物,若将500mL废水中的CN-完全氧化成N2和CO2,转移______mol e-。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有如下微粒:
①I2 ②Br- ③Na+ ④Fe2+ ⑤H+ ⑥Fe3+
⑦Mg ⑧Cl2 ⑨HCl ⑩H2O S SO2
其中在反应中只能作还原剂的有 , 只能作氧化剂的有 , 既可作氧化剂又可作还原剂的有。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A.液态HCl、固态NaCl均不导电,所以HCl、NaCl均是非电解质
B.NH3、CO2的水溶液均能导电,所以NH3、CO2均是电解质
C.蔗糖、酒精在水溶液里或熔融状态时均不导电,所以它们是非电解质
D.铜、石墨均导电,所以它们是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①2K2CrO4+H2SO4![]() K2Cr2O7+K2SO4+H2O
K2Cr2O7+K2SO4+H2O
②K2Cr2O7+6FeSO4+7H2SO4![]() 3Fe2(SO4)3+ Cr2(SO4)3 +K2SO4+7H2O
3Fe2(SO4)3+ Cr2(SO4)3 +K2SO4+7H2O
③Fe2(SO4)3+2HI![]() 2FeSO4+I2+H2SO4
2FeSO4+I2+H2SO4
下列结论正确的是
A. ①②③均是氧化还原反应
B. 氧化性强弱顺序是K2Cr2O7>Fe2(SO4)3>I2
C. 反应②中氧化剂与还原剂的物质的量之比为6∶1
D. 反应③中0.1 mol还原剂共失去电子数为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: ①亚硝酸钠(NaNO2)是一种食品添加剂,为无色、无气味的同体,具有防腐和抗氧化作用。②AgNO2是一种微溶于水、易溶于酸的浅黄色固体。
I.问题探究
(1)人体正常的血红蛋白中应含Fe2+,误食亚硝酸盐(如NaNO2)会致使机体组织缺氧,出现青紫而中毒,原因是___________。若发生中毒时,你认为下列物质有助于解毒的是____(填字母)。
A.牛奶 B.Mg(OH)2 C.维生素C D.小苏打
(2)由于亚硝酸钠和食盐性状相似,曾多次发生过将NaNO2误当食盐食用的事件。要区别NaNO2和NaCl两种固体,你需用的试剂是_______________。
II.实验测定
为了测定某样品中NaNO2的含量,某同学进行如下实验:
①称取样品ag,加水溶解,配制成100mL溶液。
②取25.00mL溶液于锥形瓶中,用0.0200mol/LKMnO4标准溶液(酸性)进行滴定,滴定结束后消耗KMnO4溶液VmL。
(1)上述实验①所需玻璃仪器除玻璃棒、胶头滴管之外还有________。
(2)在进行滴定操作时,KMnO4溶液盛装在______(填“酸式”或“碱式”)滴定管中。当滴入最后一滴溶液,________时达到滴定终点。
(3)滴定过程中发生反应的离子方程式是________;测得该样品中NaNO2的质量分数为_____。
(4)若滴定管未用KMnO4标准溶液润洗就直接注入,则测定结果______(填“偏大”、“偏小”或“无影响”,下同);若滴定过程中刚出现颜色变化就停止滴定,则测定结果________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.纯水导电性很差,所以水不是电解质
B.判断某化合物是否为电解质,应看其在一定条件下能否电离
C.酸、碱和盐类都属于电解质,其他化合物都不是电解质
D.NaCl和HCl都是电解质,所以它们熔融状态下都能导电
查看答案和解析>>
科目:高中化学 来源: 题型:
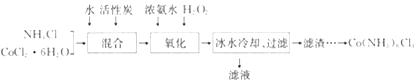
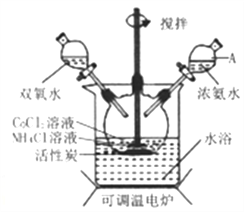
【题目】实验室利用CoCl2·6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成橙黄色晶体Co(NH3)6Cl3,实验流程和装置图如下:
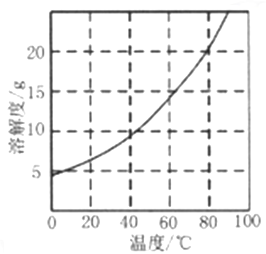
已知:①不同温度下,Co(NH3)6Cl3在水中溶解度曲线如图所示。
②Co(NH3)6Cl3 在溶液中主要以Co(NH3)63+和Cl- 形式存在,加入少量浓盐酸有利于结晶析出。
③Ksp[Co(OH)2]=1.09×10-15,Ksp[Co(OH)3]=1.6×10-44。
回答下列问题:
(1)图中仪器A的名称是_______;在实验过程中NH4Cl除作反应物外,还可防止在滴加氨水时生成粉红色Co(OH)2沉淀,其原理是_______。
(2)氧化过程在图所示装置中进行,生成Co(NH3)6Cl3。
①氧化时须先加入氨水,再加入H2O的目的是_______;该反应的离子方程式为_______。
②反应时需要控制温度在50~60℃之间,温度不能过高的原因是_______。
(3)冰水冷却的目的是_______ ;滤渣中所含有的主要杂质为_______。
(4)请完成由过滤后所得滤渣获取Co(NH3)6Cl3的实验方案:将滤渣加入沸水中,充分搅拌,趁热过滤,_______,再用少许乙醇洗涤,低温干燥。
(5)上述实验过程中若不使用活性炭作催化剂,则会得到紫红色晶体Co(NH3)5Cl3(M=250.5g·mol-1)。取2.505g紫红色晶体,溶于水后加入足量AgNO3溶液,生成白色沉淀2.870g,写出该反应的化学方程式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下反应会导致溶液导电性减弱最明显的是( )
A.Na2SO4溶液加入BaCl2固体
B.Ba(OH)2溶液中加入CuSO4(少量)固体
C.NaOH溶液通入HCl
D.H2O中加入NaCl固体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com