
【题目】一定温度下,水溶液中H+的浓度变化曲线如图所示,下列说法正确的是( )

A. 该温度下,加入FeCl3可能引起由b向a的变化
B. 该温度下,水的离子积常数为1.0×10-13
C. 升高温度,可能引起由c向b的变化
D. 该温度下,稀释溶液可能引起由c向d的变化
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:
【题目】向10mL0.1mol/L二元弱酸H2A溶液中滴加0.1mol/LNaOH溶液,溶液中各组分物质的量分数δ(X) [δ(X)=![]() ]随pH的变化如图所示。下列叙述错误的是
]随pH的变化如图所示。下列叙述错误的是
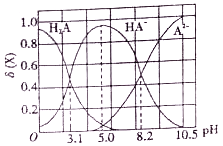
A. Ka1(H2A)为10-3.1
B. pH=5.0时,c(Na+)>c(HA-)>c(H+)>c(OH-)>c(A2-)
C. pH=8.2时,c(Na+)+c(H+)=c(OH-)+3c(A2-)
D. pH由5.0调至10.5时,主要反应的离子方程式为HA-+OH-=A2-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列分子或离子在酸性条件下都能氧化KI,自身发生如下变化:
H2O2→H2O IO3-→I2 MnO4-→Mn2+ HNO2→NO
如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是( )
A.H2O2
B.IO3-
C.MnO4-
D.HNO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写不正确的是
A.用两块铜片作电极电解盐酸:Cu + 2H+ ![]() H2↑ + Cu2+
H2↑ + Cu2+
B.NaOH溶液与足量的Ca(HCO3)2溶液反应:2HCO3- + 2OH- + Ca2+==CaCO3↓+ 2H2O
C.等物质的量的FeBr2和Cl2在溶液中的反应:2Fe2+ + 2Br - + 2Cl2==2Fe3+ + Br2 + 4Cl -
D.氨水吸收少量的二氧化硫:2NH3·H2O + SO2==2NH4+ +SO32- + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2 g Cu2S和CuS的混合物在酸性溶液中用400 mL 0.075 mol·L-1 KMnO4溶液处理,发生反应如下:
![]() +5Cu2S+44H+= 10Cu2++5SO2↑+8Mn2++22H2O
+5Cu2S+44H+= 10Cu2++5SO2↑+8Mn2++22H2O
![]() +5CuS+28H+ = 5Cu2++5SO2↑+6Mn2++14H2O
+5CuS+28H+ = 5Cu2++5SO2↑+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350 mL 0.1 mol·L-1(NH4)2Fe(SO4)2溶液完全反应。(1)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式
______![]() +______Fe2++______H+ =______Mn2++______Fe3++______H2O
+______Fe2++______H+ =______Mn2++______Fe3++______H2O
(2)KMnO4溶液与混合物反应后,剩余KMnO4的物质的量为________mol。
(3)混合物中Cu2S的质量分数为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的反应,属于同一反应类型的是( )
A.由溴丙烷水解制丙醇;由丙烯与水反应制丙醇
B.由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸
C.由乙酸和乙醇制乙酸乙酯;由苯甲酸乙酯水解制苯甲酸和乙醇
D.由氯代环己烷消去制环己烯;由丙烯加溴制1,2-二溴丙烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1mol/l的Na2SO3溶液40mL,恰好将0.002mol的X2O42-还原,Na2SO3被氧化成Na2SO4 则元素X在还原产物中的化合价是( )
A. +1 B. +2 C. +3 D. +4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com