
【题目】(1)用O2将HCl转化为Cl2,可提高效益、减少污染。新型RuO2催化剂对上述HCl转化为Cl2的总反应具有更好的催化活性。
①实验测得在一定压强下,总反应的HCl平衡转化率随温度变化的αHCl~T曲线如图,则总反应的ΔH__0(填“>”、“=”或“<”);A、B两点的反应速率中较大的是__。
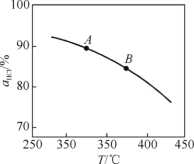
②下列措施有利于提高αHCl的有____(填字母)。
A.增大n(HCl) B. 增大n(O2)
C. 使用更好的催化剂 D. 移去H2O
(2)乙苯催化脱氢制苯乙烯反应:![]() +H2(g),工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1∶9),控制反应温度600 ℃,并保持体系总压为常压的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如图。
+H2(g),工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1∶9),控制反应温度600 ℃,并保持体系总压为常压的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如图。
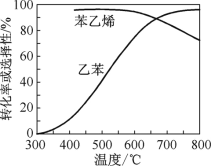
①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实:_________。
②控制反应温度为600 ℃的理由是_______。
【答案】< B BD 正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积增大,平衡向正反应方向移动 600 ℃时乙苯的转化率与苯乙烯的选择性均较高,温度过低,反应速率较慢,乙苯的转化率较低,温度过高,苯乙烯的选择性下降,高温下催化剂可能失去活性,且消耗能量较大
【解析】
(1)①根据图像结合温度对化学反应速率与化学平衡的影响效果作答;
②改变措施有利于提高αHCl,应使平衡向正反应方向移动,注意不能只增加HCl的浓度;
(2) ①保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向气体体积增大的方向移动;
②600℃时乙苯的转化率与苯乙烯的选择性均较高;结合温度对乙苯转化率、苯乙烯选择性、温度对反应速率与催化剂的影响及消耗能量等,分析控制反应温度为600℃的理由。
(1)①由图可知,温度越高,平衡时HCl的转化率越小,说明升高温度平衡向逆反应方向移动,则正反应为放热反应,即△H<0;升高温度化学反应速率增大,则A、B两点的反应速率中较大的是B,故答案为:<;B;
②A.增大n(HCl),HCl浓度增大,平衡右移,但HCl的转化率降低,A项错误;
B.增大n(O2),氧气浓度增大,平衡右移,HCl的转化率提高,B项正确;
C.使用更好的催化剂,加快反应速率,缩短到达平衡的时间,不影响平衡移动,HCl的转化率不变,C项错误;
D.移去生成物H2O,有利于平衡右移,HCl的转化率增大,D项正确,
故选:BD;
(2) ①正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动,提高乙苯的平衡转化率;
②600 ℃时乙苯的转化率与苯乙烯的选择性均较高,温度过低,反应速率较慢,乙苯的转化率较低,温度过高,苯乙烯的选择性下降,高温下催化剂可能失去活性,且消耗能量较大。
故选择600℃左右。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某化学兴趣小组探究铝与稀盐酸反应速率的影响因素,用等质量的铝和等体积、等浓度的足量稀盐酸反应,得到的3组实验数据如下:
实验编号 | 铝的形状 | 反应温度/℃ | 收集100mLH2所需的时间 |
① | 铝粉 | 20 | 21 |
② | 铝片 | 20 | 82 |
③ | 铝片 | 30 | 35 |
回答下列问题:
(1)写出铝与稀盐酸反应的化学方程式______________________。
(2)探究温度对该反应速率影响的对比实验是③和_______ (填实验编号),得出的实验结论是________。
(3)若将该实验中“收集100mL H2所需时间改为“测量相同时间内生成H2的体积”,可选用的排水量气装置为下图中的______________(填装置代号)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请完成实验室制取蒸馏水的相关内容(装置图见图 1)
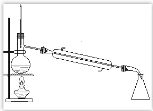
图 1
(1)蒸馏的原理:利用_____不同除去液体混合物中难挥发或不挥发的杂质。
(2)为了避免加热时液体发生暴沸现象,可以在蒸馏烧瓶里加入少量_____。
(3)冷凝管套管下端的开口用橡皮管与自来水龙头相连接,上端开口接上橡皮管后通到水 槽下水道里。即:冷却水从_____进,从_____出。
(4)温度计下端水银球应置于_____处。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,HNO2和CH3COOH的电离常数分别为5.0×10-4和1.7×10-5。将pH相同、体积均为V0的两种酸溶液分别加水稀释至体积V,pH随![]() 的变化如图所示,下列叙述错误的是
的变化如图所示,下列叙述错误的是
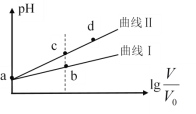
A.曲线Ⅰ代表CH3COOH溶液
B.溶液中水的电离程度:b点小于c点
C.相同体积a点的两种酸分别与NaOH溶液恰好中和后,溶液中n(NO2-)>n(CH3COO-)
D.由c点到d点,溶液中![]() 保持不变(其中HA、A-分别代表相应的酸和酸根离子)
保持不变(其中HA、A-分别代表相应的酸和酸根离子)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1是课本“还原铁粉与水蒸气反应”的实验装置图。
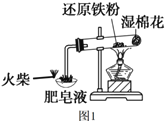
(1)铁粉与水蒸气反应的化学方程式是___。
(2)证明还原铁粉与水蒸气发生了反应的现象是___。
某同学设计图2装置进行“铁与水蒸气反应”的实验。(图中部分夹持及尾气处理装置略)
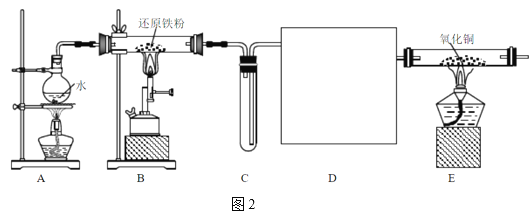
(3)图1装置中湿棉花的作用与图2中___(填“A、B、C、D、E”)装置的作用一样。
(4)装置D的作用是干燥氢气,请在方框内补充完整的装置和试剂___。
(5)实验结束,该同学取反应后装置B中固体混合物溶于足量稀硫酸,再向其中滴加几滴KSCN溶液,振荡,未见溶液变红,得出结论“反应后装置B中固体混合物”不含Fe3O4。你认为正确吗?为什么?你认为___,理由是___。
(6)某同学为实现“常温下铁与液态水的反应”设计了图3装置。实验中发现碳棒上冒气泡,蒸馏水中出现白色沉淀。书写该实验发生的化学方程式___。
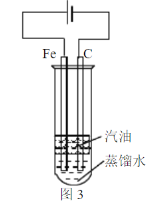
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素的核电荷数为X元素的2倍。下列说法正确的是( )
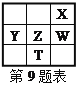
A. X、W、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增
B. Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增
C. YX2晶体熔化、液态WX3气化均需克服分子间作用力
D. 根据元素周期律,可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如下图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )

A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:X>W>Z
C. 最简单气态氢化物的热稳定性:Y>X>W>Z
D. 元素X、Z、W的最高化合价分别与其主族序数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知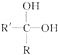 会发生反应变为
会发生反应变为![]() (R与R′可以为烃基,也可以为H),则写出下列物质与NaOH水溶液充分反应后所得有机物的结构简式。
(R与R′可以为烃基,也可以为H),则写出下列物质与NaOH水溶液充分反应后所得有机物的结构简式。
(1)CH3Cl:___________
(2)CH2Cl2:______________
(3)CHCl3:_________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com