
 (1)写出葡萄糖发生银镜反应的化学方程式CH2OH(CHOH)4CHO+2Ag(NH3)2OH $\stackrel{加热}{→}$CH2OH(CHOH)4COONH4+2Ag↓+3NH3+H2O.
(1)写出葡萄糖发生银镜反应的化学方程式CH2OH(CHOH)4CHO+2Ag(NH3)2OH $\stackrel{加热}{→}$CH2OH(CHOH)4COONH4+2Ag↓+3NH3+H2O.分析 (1)葡萄糖含有醛基,能够被银氨溶液氧化,发生银镜反应;
(2)设有机物分子中有n个O-H键,烃基和羟基上氢原子个数之比为2:1,则C-H键数为2n,其分子式为CxH3nOn(x、n均为正整数),则12x+19n=62,据此讨论确定该有机物的结构简式.同一碳原子上不能连有两个-OH;
(3)苯酚钠通入二氧化碳生成苯酚和碳酸氢钠;
(4)该有机物含有碳碳双键,可发生加成、加聚、氧化反应,含有酯基,可发生水解反应,含有羧基,具有酸性,可发生酯化反应,含有羟基,可发生氧化、取代和消去反应.
解答 解:(1)葡萄糖发生银镜反应的化学反应方程式为:CH2OH(CHOH)4CHO+2Ag(NH3)2OH $\stackrel{加热}{→}$CH2OH(CHOH)4COONH4+2Ag↓+3NH3+H2O,故答案为:CH2OH(CHOH)4CHO+2Ag(NH3)2OH $\stackrel{加热}{→}$CH2OH(CHOH)4COONH4+2Ag↓+3NH3+H2O;
(2)设有机物分子中有n个O-H键,则C-H键数为2n,其分子式为CxH3nOn(x、n均为正整数)
则12x+19n=62
讨论:当n=1,x=3.58(不合理,舍去)
当n=2,x=2(合理)
有机物的分子式为C2H6O2,含有2个-OH,故结构简式为HOCH2CH2OH,
故答案为:HOCH2CH2OH;
(3)碳酸的酸性比苯酚的酸性强,所以苯酚钠通入二氧化碳生成苯酚和碳酸氢钠,反应的化学方程式为:C6H5ONa+CO2+H2O→C6H6OH+NaHCO3,
故答案为:C6H5ONa+CO2+H2O→C6H6OH+NaHCO3;
(4)该有机物含有碳碳双键,可发生加成、加聚、氧化反应,则②⑥正确;
含有酯基,可发生水解反应,则①⑤正确;
含有羧基,具有酸性,可发生酯化反应,则①④正确;
含有羟基,可发生氧化、取代和消去反应,则①③④⑥正确;
则正确的有①②③④⑤⑥,
故答案为:C.
点评 本题考查了常见有机物分类方法判断、有机物分子式与结构式的确定,难度中等,根据烃基和羟基上氢原子个数之比为2:1确定分子中H原子与O原子的数目之比是解题的关键,注意有机物分子式确定中讨论方法的运用.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体).下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体).下列分析或结果错误的是( )| A. | 第二份溶液中最终溶质为FeSO4 | |
| B. | OA段产生的是NO,AB段的反应为Fe+2Fe3+═3Fe2+,BC段产生氢气 | |
| C. | 原混合酸中NO3- 物质的量为0.1 mol | |
| D. | H2SO4 浓度为2.5 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 新旧平衡态时,A的体积分数相同 | |
| B. | 由旧平衡变为新平衡态,平衡常数不变 | |
| C. | 旧平衡态的v正与新平衡态的v逆相等 | |
| D. | t2时刻速率突变的原因是向密闭容器中加C或B |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
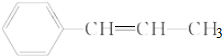 的说法正确的是( )
的说法正确的是( )| A. | 所有碳原子都可能在同一平面上 | |
| B. | 最多只可能有6个碳原子在同一平面上 | |
| C. | 有5个原子可能在同一直线上 | |
| D. | 所有原子可能在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “冰,水为之,而寒于水”说明相同质量的水和冰,冰的能量高 | |
| B. | 水加热到很高的温度都难以分解,主要原因是水分子间可以形成氢键的缘故 | |
| C. | 增大反应物浓度,可增大单位体积内活化分子数,使单位时间内有效碰撞次数增加 | |
| D. | 同时改变两个变量来研究反应速率的变化,能更快得出有关规律 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com