
| A、1:1 | B、2:1 |
| C、1:2 | D、1:3 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、Na2O是淡黄色固体,和水反应生成NaOH,是碱性氧化物 |
| B、在Na2O2与水的反应中,氧化剂是Na2O2,还原剂是水 |
| C、SO2通入品红中红色褪去,加热后红色恢复 |
| D、将Cl2与SO2按物质的量之比1:1通入紫色石蕊试液,溶液先变红后褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、纳米材料是指一种称为“纳米”的新物质制成的材料 |
| B、复合材料一般有强度高、质量轻、耐高温、耐腐蚀等优异性能,其综合性质超过了单 一材料 |
| C、光导纤维是以二氧化硅为主要原料制成的 |
| D、合成纤维的主要原料是石油、天然气、煤等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO--酸性氧化物 Na2O2--碱性氧化物 Al2O3--两性氧化物 |
| B、漂白粉--混合物 胆矾--纯净物 HD--单质 |
| C、纯碱--碱 硫化氢--酸 小苏打--酸式盐 |
| D、盐酸--强电解质 硫酸钡--强电解质 醋酸--弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、可逆反应在其他条件不变时,升高温度,可以减小反应的活化能,加快反应速率 |
| B、S电子云是球形对称的,P电子云是纺锤形,电子云中每个小黑点代表一个电子 |
| C、氮原子的第一电离能低于氧原子的第一电离能,因为氮比氧非金属性弱 |
| D、Fe3+ 比Fe2+稳定,因为Fe3+价电子构型是3d5,d亚层处于半充满状态,稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
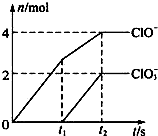 向一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中有三种含氯元素的离子,其中两种离子的物质的量(n)与反应时间(t)的曲线如图所示.已知,生成ClO3-的反应为:6Ca(OH)2+6Cl2
向一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中有三种含氯元素的离子,其中两种离子的物质的量(n)与反应时间(t)的曲线如图所示.已知,生成ClO3-的反应为:6Ca(OH)2+6Cl2
| ||
| n(ClO-) | ||
n(Cl
|
| n(ClO-) | ||
n(Cl
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫化亚铁溶于稀硝酸中:FeS+2H+═Fe2++H2S↑ |
| B、少量CO2通入硅酸钠溶液中:SiO32-+2CO2+2H2O═H2SiO3↓+2HCO3- |
| C、含等物质的量的KHCO3和Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O |
| D、硫化钠水溶液呈碱性:S2-+2H2O?H2S+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com