
| A. | 20g重水(D2O)含有的电子数为10 NA | |
| B. | 46g NO2和N2O4的混合物中所含氧原子个数为6.02×1023 | |
| C. | 0.1mol过氧化钠与足量的水反应,转移的电子数为 0.2NA | |
| D. | 1L 0.3 mol/LNa2SO4溶液中,含有Na+和SO42-总数为0.6 NA |
分析 A、D2O分子中含有10个电子,20个重水的物质的量为1mol,含有10mol电子;
B、NO2和N2O4的最简式均为NO2;
C、过氧化钠与水的反应为歧化反应;
D、1molNa2SO4中含2mol钠离子和1molSO42-.
解答 解:A、20克D2O的物质的量为1mol,1mol重水中含有10mol电子,含有的电子数为10NA,故A正确;
B、NO2和N2O4的最简式均为NO2,故46g NO2和N2O4的混合物中含有NO2的物质的量n=$\frac{m}{M}$=$\frac{46g}{46g/mol}$=1mol,故含有2mol氧原子,故B错误;
C、过氧化钠与水的反应为歧化反应,1mol过氧化钠转移1mol电子,故0.1mol过氧化钠转移0.1mol电子,故C错误;
D、1L 0.3 mol/LNa2SO4溶液中含Na2SO4的物质的量为0.3mol,而1molNa2SO4中含2mol钠离子和1molSO42-,故0.3molNa2SO4中含有的钠离子和硫酸根的物质的量为0.9mol,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 培优三好生系列答案
培优三好生系列答案科目:高中化学 来源: 题型:解答题
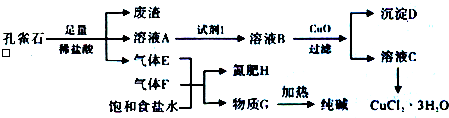
| 金属离子 | Fe3+ | Fe2+ | Cu2+ | |
| PH | 氢氧化物开始沉淀 | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀 | 3.2 | 9.0 | 6.7 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18个纵横代表18个族,7个主族、8个副族 | |
| B. | 短周期共有32种元素 | |
| C. | 元素周期表共有七个横行代表七个周期 | |
| D. | 第IA族全部是金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铝溶液中加入过量的氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O | |
| C. | Fe (NO3)2与HI的反应:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O | |
| D. | 少量SO2通入漂白粉溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)已知 2Na+2H2O=2NaOH+H2↑中水是氧化剂,请写出一个水做还原剂的置换反应的化学反应方程式2F2+2H2O=4HF+O2↑
(1)已知 2Na+2H2O=2NaOH+H2↑中水是氧化剂,请写出一个水做还原剂的置换反应的化学反应方程式2F2+2H2O=4HF+O2↑查看答案和解析>>
科目:高中化学 来源: 题型:填空题
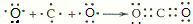 ;用电子式表示C、D两元素形成化学键的过程
;用电子式表示C、D两元素形成化学键的过程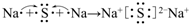 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
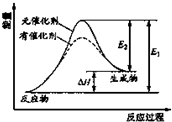 某反应的过程中能量辩护如图实数(图中E1表示正反应的活化能,E2表示逆反应的活化能),下列叙述制取的是( )
某反应的过程中能量辩护如图实数(图中E1表示正反应的活化能,E2表示逆反应的活化能),下列叙述制取的是( )| A. | 该反应为放热反应 | |
| B. | 催化解能改变反应的焓变 | |
| C. | 催化解能降低反应所需活化能,增大活化分子百分数 | |
| D. | 逆反应的活化能大于正反应的活化能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com