
| A. | 原子序数=原子核内质子数 | |
| B. | 元素的种数=原子种数 | |
| C. | 元素周期表中主族序数=原子的最外层电子数 | |
| D. | 元素周期表中周期数=原子的电子层数 |
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ① | D. | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以惰性材料为电极,KOH溶液为电解质构成原电池,负极反应式为H2-2e-=2H+ | |
| B. | 铜、锌在稀硫酸溶液中构成原电池,正极反应式为2H++2e-=H2↑ | |
| C. | 以铜为电极将2Fe3++Cu=2Fe2++Cu2+设计成原电池,正极反应式为Cu-2e-=Cu2+ | |
| D. | 以铝、铁为电极,在氢氧化钠溶液中构成原电池,负极反应式为Al-3e-=Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20 mL 12 mol/L的盐酸 | B. | 10 mL 18 mol/L的硫酸 | ||
| C. | 80 mL 2 mol/L的硫酸 | D. | 40 mL 14 mol/L的硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都能使溴水和酸性高锰酸钾溶液褪色 | |
| B. | 都能发生加聚反应生成高分子化合物 | |
| C. | 都不溶于水,且密度比水小 | |
| D. | 分子中各原子都处于同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{53}^{131}$I的化学性质与${\;}_{53}^{127}$I相同 | |
| B. | ${\;}_{53}^{131}$I的原子序数为53 | |
| C. | ${\;}_{53}^{131}$I的原子核外电子数为78 | |
| D. | ${\;}_{53}^{131}$I的原子核内中子数多于质子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最易失去的电子能量最高 | |
| B. | L层电子比K层电子能量高 | |
| C. | p轨道电子能量一定高于s轨道电子能量 | |
| D. | 在离核最近区域内运动的电子能量最低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
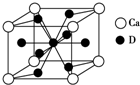 A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请回答下列问题:
A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 测定次数 | 盐酸的体积/mL | KOH溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com