
| 测定次数 | 盐酸的体积/mL | KOH溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
分析 (1)配制100mL 1.5mol/L-1KOH溶液,必须使用规格为100mL的容量瓶;
(2)①根据反应结束前溶液为无色,反应结束时溶液为浅红色判断滴定终点;
②分别计算出三次滴定消耗氢氧化钾溶液的体积,然后计算出平均值,最后根据中和反应实质计算出稀释后盐酸的浓度,然后根据稀释过程中溶质的物质的量不变计算出36.5%盐酸浓度.
解答 解:(1)配制100mL 1.5mol/L-1KOH溶液时,需要用的玻璃仪器有:烧杯、玻璃棒、胶头滴管和100mL容量瓶,所以还缺少规格为100mL的容量瓶,
故答案为:100mL容量瓶;
(2)①用氢氧化钾溶液滴定盐酸,反应结束前溶液为无色,滴定结束时溶液为浅红色,则滴定终点的现象为:溶液由无色变为浅红色,且半分钟内不褪色,
故答案为:溶液由无色变为浅红色,且半分钟内不褪色;
②计算出三次滴定消耗氢氧化钾溶液的体积分别为:21.03mL-1.02mL=20.01mL、21.99mL-2.0mL=19.99mL、20.20mL-0.02mL=20.00mL,所以三次滴定消耗氢氧化钾溶液的平均体积为:$\frac{20.01mL+19.99mL+20.00mL}{3}$=20.0mL,
则稀释后该盐酸的物质的量浓度为:$\frac{1.5mol/L×0.02L}{0.025L}$=1.2mol/L,稀释过程中溶质的物质的量不变,则稀释前盐酸浓度为:$\frac{1.2mol/L×0.2L}{0.02L}$=12mol/L,即:36.5%盐酸浓度为12mol/L,
故答案为:12mol/L.
点评 本题考查了中和滴定,题目难度不大,明确中和滴定原理及操作方法为解答关键,注意掌握滴定终点现象的判断方法,试题培养了学生的分析能力及化学实验能力.


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子序数=原子核内质子数 | |
| B. | 元素的种数=原子种数 | |
| C. | 元素周期表中主族序数=原子的最外层电子数 | |
| D. | 元素周期表中周期数=原子的电子层数 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | OH-+2CO32-+3H+→2HCO3-+H2O | B. | 2OH-+CO32-+3H+→HCO3-+2H2O | ||
| C. | 2OH-+CO32-+4H+→CO2↑+3H2O | D. | OH-+CO32-+3H+→CO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
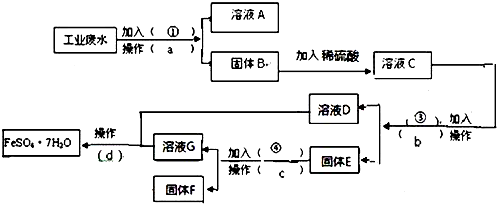
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚乙烯食品包装袋、食物保鲜膜都是无毒的高分子化合物 | |
| B. | 高纯度的二氧化硅广泛用于制作光导纤维,遇强碱会“断路” | |
| C. | 煤经过气化和液化两种物理变化,可变为清洁能源 | |
| D. | 加热能杀死甲型H1N1流感病毒,主要是加热后使病毒中的蛋白质变性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
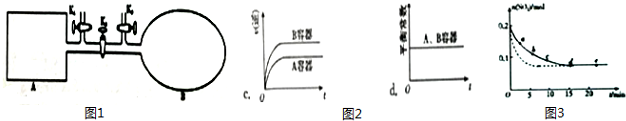
| 编号 | a | b | c | d | e |
| n(SO2)/mol | 0.16 | 0.12 | 0.09 | 0.07 | 0.07 |
| t/min | 2 | 5 | 8 | 15 | 22 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28g乙烯中存在的电子总数为12NA | |
| B. | 标准状况下,22.4LHF的物质的量为1mol | |
| C. | 铅蓄电池电解氯化钠溶液,得到标况下22.4L氢气,理论上铅蓄电池中消耗氢离子个数为4NA | |
| D. | lmol的Na2C03溶于盐酸形成混合溶液1L,常温下在pH=4时,c(CO32- )+c(H2C03)=0.lmol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com