
| 71g |
| 71g/mol |
| 71g |
| 67.5g/mol |
| 71×5 |
| 67.5 |
| 71 |
| 13.5 |
| ||
| 2mol |
| 71 |
| 27 |


 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:
| A、萤石可溶于水,氟化银也可溶于水 |
| B、碱金属元素单质均为银白色固体,且在一定条件下与氧气反应均可得到过氧化物 |
| C、在金属活动性顺序表中钠比铜活泼,所以钠可以从硫酸铜溶液中置换出铜单质 |
| D、虽然氟元素的非金属性强于氯元素,氟单质也不能从氯化钠溶液中置换出氯单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
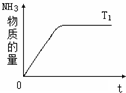 在一定温度下,向容积不变的容器中加入2mol N2、8mol H2及固体催化剂,使之反应.已知:N2(g)+3H2(g)?2NH3(g);△H=-92.2kJ?mol-1.平衡时,容器内气体压强为起始时的80%.
在一定温度下,向容积不变的容器中加入2mol N2、8mol H2及固体催化剂,使之反应.已知:N2(g)+3H2(g)?2NH3(g);△H=-92.2kJ?mol-1.平衡时,容器内气体压强为起始时的80%.查看答案和解析>>
科目:高中化学 来源: 题型:
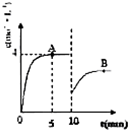 在一定条件下,合成塔中氮气和氢气的起始浓度分别为a mol?L-1和b mol?L-1,反应为:
在一定条件下,合成塔中氮气和氢气的起始浓度分别为a mol?L-1和b mol?L-1,反应为:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH3的百分含量增大 |
| B、NH3的浓度增大 |
| C、H2的转化率不变 |
| D、N2的转化率提高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com