
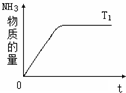
 在一定温度下,向容积不变的容器中加入2mol N2、8mol H2及固体催化剂,使之反应.已知:N2(g)+3H2(g)?2NH3(g);△H=-92.2kJ?mol-1.平衡时,容器内气体压强为起始时的80%.
在一定温度下,向容积不变的容器中加入2mol N2、8mol H2及固体催化剂,使之反应.已知:N2(g)+3H2(g)?2NH3(g);△H=-92.2kJ?mol-1.平衡时,容器内气体压强为起始时的80%.| 2x |
| (2-x+8-3x+2x) |
| 3 |
| 8 |
| 22 |
| 1×52 |
| 42 |
| (X-2)×23 |
 ,故答案为:
,故答案为: .
.


 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源: 题型:
| A、向氢氧化钡溶液中加硫酸溶液:Ba2++SO42-=BaSO4↓ | ||||
| B、通常情况下铁与稀硝酸反应:Fe+2H+=Fe2++H2↑ | ||||
C、二氧化锰与浓盐酸共热:MnO2+4 HCl (浓)
| ||||
| D、碳酸氢钠溶液中加入少量的澄清石灰水:2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| N | + 5 |
| A、C60的相对分子质量为720g/mol | ||
| B、H2与H3属于同素异形体 | ||
| C、O2与O4属于同位素 | ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、全部 | B、②③⑤ |
| C、①③⑤⑥ | D、②③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
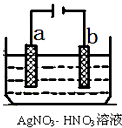 按要求完成下列问题:
按要求完成下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若 a=b+c,B的物质的量分数变大 |
| B、若 a>b+c,B 的物质的量分数减小 |
| C、若a>b+c时,A的转化率不变 |
| D、若a<b+c时,A的转化率变小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com