
【题目】在t℃下,某反应达到平衡,平衡常数K=c(NO)c(SO3)/c(NO2)c(SO2)。恒容时,温度升高,NO浓度减小。下列说法正确的是( )
A.该反应的焓变为正值B.恒温下增大压强,反应体系的颜色加深
C.升高温度,逆反应速率减小D.该反应化学方程式为NO+SO3![]() NO2+SO2
NO2+SO2
 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种金属片在稀盐酸中,用导线连接,可以组成原电池,实验结果如图所示:则四种金属的活泼性由强到弱的顺序为( )
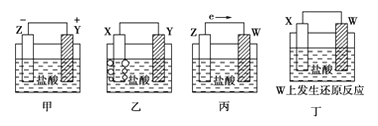
A. Z>Y>X>WB. Z>X>Y>WC. Z>Y>W>XD. Y>Z>X>W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置探究铁在海水中的电化学防护,下列说法不正确的是

A.若X为锌棒,开关K置于M处,可减缓铁的腐蚀
B.若X为锌棒,开关K置于M处,铁电极的反应:Fe2e =Fe2+
C.若X为碳棒,开关K置于N处,可减缓铁的腐蚀
D.若X为碳棒,开关K置于N处,铁电极的反应:2H++2e=H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向炙热的铁屑中通入氯气生产无水氯化铁;向炽热铁屑中通入氯化氢生产无水氯化亚铁。现用如图所示的装置模拟上述过程进行实验。
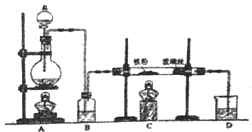
回答下列问题:
(1)制取无水氯化铁的实验中,A中反应的化学方程式为___,B中加入的试剂是___,D中盛放的试剂____。
(2)制取无水氯化亚铁的实验中,装置A用来制取____,尾气的成分是___,仍用D装置进行尾气处理,存在的问题是____、____。
(3)若操作不当,制得的FeCl2会含有少量FeCl3,原因可能是____,欲制得纯净的FeCl2,在实验操作中应先___,再____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组取一定质量的硫酸亚铁固体,利用下图装置进行实验。

实验过程及现象如下:
①通一段时间氮气后加热,A中固体变为红棕色,B中有白色沉淀,D试管中有无色液体;
②用带火星的木条靠近装置D的导管口,木条复燃;
③充分反应后停止加热,冷却后取A中固体,加盐酸,固体溶解,溶液呈黄色;
④将③所得溶液滴入D试管中,溶液变为浅绿色。
已知:SO2熔点-72℃,沸点-10℃;SO3熔点16.8℃,沸点44.8℃。
(1)实验③反应的离子方程式是__________。
(2)分解过程除产生使木条复燃的气体外,仅由A中固体颜色变化推测,还一定有______气体,依据是_________。
(3)实验④反应的离子方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,横坐标表示通入气体或加入试剂的体积,纵坐标表示产生沉淀的质量。请把符合下列各种情况的图像字母代码分别填入题后。
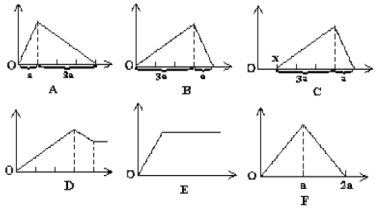
(1)向石灰水中通入二氧化碳:__________。
(2)向AlCl3溶液中加入氨水:__________。
(3)向盐酸和氯化铝的混合溶液中逐滴加入氢氧化钠溶液:__________。
(4)向NaAlO2溶液中滴加盐酸:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应2A(s)+3B(g) ![]() C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是( )
C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是( )
①增加A的量,平衡向正反应方向移动
②升高温度,平衡向逆反应方向移动,v(正)减小
③压强增大一倍,平衡不移动,v(正)、v(逆)不变
④增大B的浓度,v(正)>v(逆)
⑤加入催化剂,B的转化率提高
A.①②B.④C.③D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列四个图像的说法中正确的是
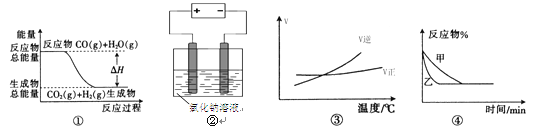
A.图①表示可逆反应“CO(g)+H2O(g)![]() CO2(g)+H2(g)”中的ΔH小于0
CO2(g)+H2(g)”中的ΔH小于0
B.图②是在长时间电解氯化钠稀溶液的电解池中,阴、阳极产生气体体积之比一定为1︰1
C.图③表示可逆反应“A2(g)+3B2(g)![]() 2AB3(g)”的ΔH大于0
2AB3(g)”的ΔH大于0
D.图④表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(s)的影响,乙的压强大
3C(g)+D(s)的影响,乙的压强大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(CH3OCH3)是无色气体,是柴油的理想替代燃料。清华大学王志良等研究了,由合成气(组成为H2、CO和少量的CO2)一步法制备二甲醚的问题,其中的主要过程包括以下三个反应:
(i)CO(g)+2H2(g)![]() CH3OH(g) △H1=-90.1 kJ/mol
CH3OH(g) △H1=-90.1 kJ/mol
(ii)CO(g)+H2O(g)![]() CO2(g)+H2(g) △H2=-41.1 kJ/mol
CO2(g)+H2(g) △H2=-41.1 kJ/mol
(iii)2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H3=-24.5 kJ/mol
CH3OCH3(g)+H2O(g) △H3=-24.5 kJ/mol
(1)由H2和CO制备二甲醚(另一产物为CO2)的热化学方程式为________。
(2)合成气初始组成为n(H2):n(CO):n(CO2)=0.67:0.32:0.01的反应体系。在250℃和5.0 MPa条件下,在1 L密闭容器中经10 min达到化学平衡时,各组分的物质的量如下表:
成分 | H2 | CO | H2O | CH3OH | CH3OCH3 |
物质的量(mol) | 0.26 | 0.01 | 0.04 | 0.02 | 0.11 |
则反应(iii)在该条件下的平衡常数是_______;在反应进行的10 min内,用CH3OH表示的反应(i)的平均速率是_______。
(3)课题组探究了外界条件,对合成气单独合成甲醇反应体系和直接合成二甲醚反应体系的影响。
①图1和图2显示了温度250 ℃和5.0 MPa条件下,合成气组成不同时,反应达到平衡时的情况。(图中M代表甲醇、D代表二甲醚、D+M代表甲醇和二甲醚。下同)
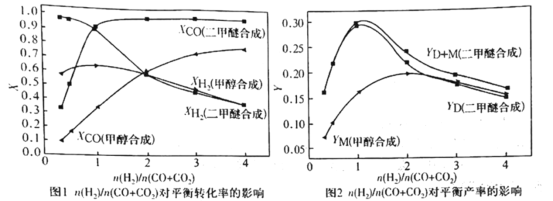
由图可知,随着合成气中H2所占比例的提高,合成甲醇的反应体系中,CO转化率的变化趋势是______。对于由合成气直接合成二甲醚的反应体系,为了提高原料转化率和产品产率,![]() 的值应控制在_____附近。
的值应控制在_____附近。
②在压强为5.0MPa、![]() =2.0及
=2.0及![]() 的条件下,反应温度对平衡转化率和产率的影响如图3和图4所示。
的条件下,反应温度对平衡转化率和产率的影响如图3和图4所示。
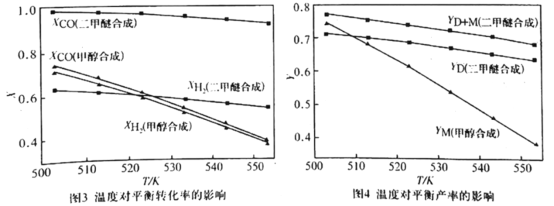
课题组认为图3所示的各反应物的转化率变化趋势符合反应特点,其理由是______。图中显示合成气直接合成二甲醚体系中,CO的转化率明显高于H2的转化率,原因是_______。图4显示随着温度增大,合成气单独合成甲醇时的产率,要比合成气直接合成二甲醚时的产率减小的快,原因是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com