
【题目】只需克服分子间作用力的是
A.NaCl 熔化B.HCl 溶于水C.氨液气化D.铜导电
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:
【题目】我国知名企业比亚迪公司开发了具有多项专利的锂钒氧化物二次电池,其成本较低,对环境无污染,能量密度远远高于其他电池,电池总反应为V2O5 + xLi![]() LixV2O5。下列说法合理的是( )
LixV2O5。下列说法合理的是( )
A. 电池在放电时,Li+向负极移动
B. 锂在放电时作正极,充电时作阳极
C. 该电池充电时阳极的反应为LixV2O5 - xe- =V2O5 + xLi+
D. V2O5只是锂发生反应的载体,不参与电池反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒和钛金属的性能都很优越,在航空航天领域用途广泛。回答下列问题:
(1)钛元素基态原子的电子排布式为______________,未成对电子数为_______________个。
(2)[TiO(H2O2)2]2+配离子呈黄色。提供中心原子孤电子对的成键原子是_____________(填元素符号),中心原子的化合价为_____________;配体之一H2O2中氧原子杂化类型为__________,H2O2分子中氧原子的价层电子对互斥模型是______________。
(3)单质钒及钛都是由______________键形成的晶体,己知金属钛是六方最密堆积,金属钒是体心立方堆积,则__________(填“钛”,或“钒”)的空间利用率较大。
(4)碳化钒主要用于制造钒钢及碳化物硬质合金添加剂,其晶胞结构如图所示。
 (小球为V原子)
(小球为V原子)
①晶胞中碳原子与钒原子的数量比为____________。
②该晶胞中与碳原子距离最近且相等的碳原子个数为_____________。
③若合金的密度为dg· cm-3,晶胞参数α=______nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来“雾霾”污染日益严重,原因之一是机动车尾气中含有NO、NO2、CO等气体,火力发电厂释放出大量的NOx、SO2和CO2等气体也是其原因,现在对其中的一些气体进行了一定的研究:
(1)用 CH4催化还原氮氧化物可以消除氮氧化物的污染。
已知:①CH4(g) + 4NO2(g) = 4NO(g) + CO2(g) + 2H2O(g) △H = - 574 kJ/mol
②CH4(g) + 4NO(g) = 2N2(g) + CO2(g) + 2H2O(g) △H = - 1160 kJ/mol
③H2O(g) = H2O(l) △H = - 44.0 kJ/mol
写出 CH4(g)与 NO2(g)反应生成 N2(g)、CO2(g)和 H2O(l)的热化学方程式: _____________________________________________________________。
(2)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体转化为无毒气体。4CO(g)+2NO2(g) ![]() 4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1
4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1
对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是________________(填代号)。

(3)用活性炭还原法也可以处理氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g) ![]() N2(g)+CO2(g) ΔH=a kJ/mol
N2(g)+CO2(g) ΔH=a kJ/mol
在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
时间/min 浓度/(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①根据图表数据分析T1℃时,该反应在0-20min的平均反应速率v(NO)=_____________________;计算该反应的平衡常数K=____________________。
②30min后,只改变某一条件,根据上表的数据判断改变的条件可能是_________(填字母代号)。
A.通入一定量的CO2 B.加入合适的催化剂
C.适当缩小容器的体积 D.通入一定量的NO
E.加入一定量的活性炭
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2:1:1,则达到新平衡时NO的转化率____________(填“升高”或“降低”),a________0(填“>”或“<”)。
(4)温度T1和T2时,分别将0.50 mol CH4和1.2mol NO2充入1 L的密闭容器中发生反应:CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g) △H=bkJ/mol。
N2(g)+CO2(g)+2H2O(g) △H=bkJ/mol。
测得有关数据如下表:
温度 | 时间/min 物质的量 | 0 | 10 | 20 | 40 | 50 |
T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | x | 0.15 |
下列说法正确的是__________________。
A.T1>T2,且b>0
B.当温度为T2、反应进行到40 min时, x>0.15
C.温度为T2时,若向平衡后的容器中再充入0.50 mol CH4和1.2mol NO2,重新达到平衡时,n(N2)<0.70mol
D.温度为T1时,若起始时向容器中充入0.50 mol CH4(g)、0.50 molNO2(g)、1.0 mol N2(g)、2.0 molCO2(g)、0.50molH2O(g),反应开始时,ν(正)>ν(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环己烯常用于有机合成。现通过下列流程,以环己烯为原料合成环醚、聚酯、橡胶,其中F可以做内燃机的抗冻剂,J分子中无饱和碳原子。
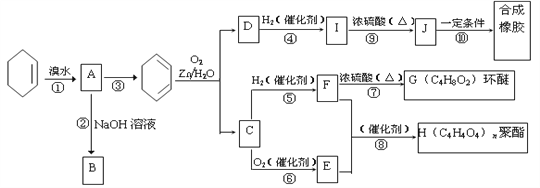
已知:R1-CH=CH-R2 ![]() R1-CHO+R2-CHO
R1-CHO+R2-CHO
(1)F的名称是___________,C中含有的官能团的名称是______________。
(2)③的反应条件是_________________________。
(3)写出下列反应类型:⑥_________________,⑨______________。
(4)写出②反应化学方程式: ____________________________。
(5)写出⑩反应化学方程式:________________________________________。
(6)试写出C与新制银氨溶液反应的化学方程式:_________________________
(7)D的一种同分异构体,可发生加成聚合反应,且能和NaHCO3反应,有三种氢原子,核磁共振氢谱面积比为1:2:3,试写出结构简式:_______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com