
【题目】下列说法中,不正确的是
A. 醋酸铅等重金属盐可使蛋白质变性
B. 氨基酸能与盐酸、氢氧化钠分别发生反应
C. 甲醛能发生氧化反应、还原反应和聚合反应
D. 油脂只能在碱性条件下发生水解反应
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列对有机物结构和性质的描述错误的是( )
A. 光照下,异丁烷与Cl2发生取代反应生成的一氯代物有2种
B. 丙烯分子中所有原子不可能在同一平面上
C. 某烃的结构简式可表示为![]() (碳原子数≤10)。已知烃分子中有两种化学环境不同的氢原子,且数目之比为3∶2,则该烃一定是苯的同系物
(碳原子数≤10)。已知烃分子中有两种化学环境不同的氢原子,且数目之比为3∶2,则该烃一定是苯的同系物
D. 卤代烃、糖类和蛋白质均可发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(前两空每空2分,后三空每空3分,共13分)氮气与氢气合成氨是化学工业中极为重要的反应,其热化学方程式可表示为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92 kJ·mol-1。请回答下列问题:
2NH3(g) ΔH=-92 kJ·mol-1。请回答下列问题:
(1)取1 mol N2(g)和3 mol H2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量___(填“大于”“等于”或“小于”)92 kJ,原因 是______________;若加入催化剂,ΔH___(填“变大”“变小”或“不变”)。
(2)已知:破坏1 mol N≡N键、1 mol H—H键需要吸收的能量分别为:946 kJ、436 kJ,则破坏1 mol N—H键需要吸收的能量为_____kJ。
(3)N2H4可视为NH3分子中的一个H被—NH2取代的产物。发射卫星用N2H4(g)为燃料,NO2为氧化剂,生成N2和H2O(g)。
已知:N2(g)+2O2(g)![]() 2NO2(g) ΔH1=+67.7 kJ·mol-1
2NO2(g) ΔH1=+67.7 kJ·mol-1
N2H4(g)+O2(g)![]() N2(g)+2H2O(g)ΔH2=-534 kJ·mol-1。
N2(g)+2H2O(g)ΔH2=-534 kJ·mol-1。
则:1 mol N2H4与NO2完全反应的热化学方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】容量瓶是用来配制一定物质的量浓度的溶液的定量仪器,其上标有:①温度 ②浓度 ③容积 ④压强 ⑤刻度线这五项中的( )
A. ①②③ B. ③④⑤ C. ①②④ D. ①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2是大气污染物,造成酸雨的主要原因,用如图所示装置可以既吸收工厂排放的废气中的SO2,又可以生成一定量的硫酸,下列说法正确的是

A. a为正极,b为负极
B. 生产过程中氢离子由右移向左
C. 从左下口流出的硫酸的质量分数一定大于50%
D. 负极反应式为SO2+2H2O-2e-=SO42-+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列判断正确的是
A.常温下,pH=1的盐酸溶液中,由水电离的H+个数为10-13NA
B.标准状况下,氧原子总数为0.2NA的CO2和NO2的混合气体,其体积为2.24L
C.常温下,5.6g铁分别与足量氯气和浓硝酸反应,转移的电子数目均为0.3NA
D.100g46%乙醇溶液中所含O-H数目为7NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,盐桥中装有用饱和Na2SO4溶液浸泡过的琼脂。下列说法正确的是

A.b电极上发生的反应:Fe2+ - e- ═ Fe3+
B.a电极上发生氧化反应:MnO4- + 8H+ + 5e- ═ Mn2+ + 4H2O
C.外电路电子的流向是从a到b
D.电池工作时,盐桥中的SO42-移向甲烧杯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将三种黑色粉末组成的混和物加入到足量的某热浓酸中,充分反应后得到蓝绿色溶液和两种气体。将从蓝绿色溶液中分离得到的盐与0.15mol还原铁粉恰好反应完全,可得浅绿色溶液和6.4g红色沉淀;将上述生成的两种气体通入足量饱和NaHCO3溶液中,仍然收集到两种气体,据此推断黑色粉末可能为
A.物质的量 FeS:CuO:Fe =1:1:1 B.物质的量 C:CuO:Fe=3:2:2
C.质量 MnO2:CuO:C=5.5:8:12 D.质量 Fe:C:CuO=7:5:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)从古至今,铁及其化合物在人类生产生活中的作用发生了巨大改变。
(1)古代中国四大发明之一的指南针是由天然磁石制成的,其主要成分是 (填字母序号)。
a.Fe b.FeO c.Fe3O4 d.Fe2O3
(2)硫酸渣的主要化学成分为:SiO2约45%,Fe2O3约40%,Al2O3约10%,MgO约5%。用该废渣制取药用辅料——红氧化铁的工艺流程如下(部分操作和条件略):

回答下列问题:
①在步骤i中产生的有毒气体可能有_____________。
②在步骤iii操作中,要除去的离子之一为Al3+。若常温时Ksp[Al(OH)3]=1.0×1032,此时理论上将Al3+沉淀完全,则溶液的pH为______。
③步骤iv中,生成FeCO3的离子方程式是_______________________________。
(3)氯化铁溶液称为化学试剂中的“多面手”。向氯化铜和氯化铁的混合溶液中加入氧化铜粉末会产生沉淀,写出该沉淀的化学式 。请用平衡移动的原理,结合必要的离子方程式,对此现象作出解释 。
(4)①古老而神奇的蓝色染料普鲁士蓝的合成方法如下:
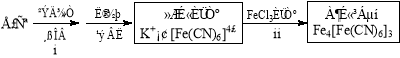
复分解反应ii的离子方程式是 。
②如今基于普鲁士蓝合成原理可检测食品中是否含CN,方案如下:
![]()
若试纸变蓝则证明食品中含有CN,请解释检测时试纸中FeSO4的作用 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com