
【题目】锌元素对婴儿及青少年的智力和身体发育有重要的作用,被称为生命火花。利用恒电势电解NaBr溶液间接将葡萄糖[CH2OH(CHOH)4CHO]氧化为葡萄糖酸[CH2OH(CHOH)4COOH],进而制取葡萄糖酸锌,装置如图所示,下列说法错误的是( )
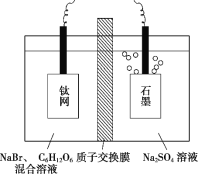
A.钛网与直流电源的正极相连,发生还原反应
B.石墨电极的反应为2H2O+2e-=H2↑+2OH-
C.电解过程中硫酸钠溶液浓度保持不变
D.生成葡萄糖酸的化学方程式为CH2OH(CHOH)4CHO+Br2+H2O=CH2OH(CHOH)4COOH+2HBr
【答案】A
【解析】
由题干可知,在钛网上NaBr将被氧化为溴单质,失电子发生氧化反应,钛网作阳极,与电源的正极相连,石墨电极作阴极,发生还原反应,电极反应为:2H2O+2e-=H2↑+2OH-。
A. 由分析可知,在钛网上NaBr将被氧化为溴单质,失电子发生氧化反应,钛网作阳极,与电源的正极相连,A项错误;
B. 石墨电极作阴极,发生还原反应,电极反应为:2H2O+2e-=H2↑+2OH-,B项正确;
C. 电解过程中,左侧发生的反应为2Br--2e-=Br2、CH2OH(CHOH)4CHO+Br2+H2O=CH2OH(CHOH)4COOH+2HBr,右侧电极反应为:2H2O+2e-=H2↑+2OH-,左侧产生的H+经过质子交换膜不断向右侧提供被消耗的H+,右侧硫酸钠溶液的浓度不变,C项正确;
D. 电解过程中溴离子氧化生成的Br2将葡萄糖氧化为葡萄糖酸,化学方程式为CH2OH(CHOH)4CHO+Br2+H2O=CH2OH(CHOH)4COOH+2HBr,D项正确;
答案选A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,0.1 mol![]() 溶于水,转移的电子数目为0.1
溶于水,转移的电子数目为0.1![]()
B.标准状况下,2.24 L氧气与2.3 g金属钠充分反应,转移的电子数为0.4![]()
C.64 g 铜粉与足量硫粉混合加热充分反应,转移电子数为![]()
D.18 g![]() 含有10
含有10![]() 个中子
个中子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中NO产生的反应为:N2(g)+O2(g)![]() 2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。下列叙述正确的是:
2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。下列叙述正确的是:

A. 温度T下,该反应的平衡常数K=![]()
B. 温度T下,随着反应的进行,混合气体的密度减小
C. 曲线b对应的条件改变可能是加入了催化剂
D. 若曲线b对应的条件改变是温度,可判断该反应的△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
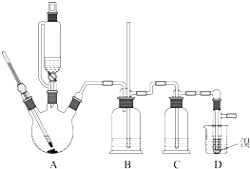
【题目】实验室制备1,2-二溴乙烷的反应原理如下:![]()
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚.用少量溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:有关数据列表如下:
回答下列问题:
乙醇 | 1,2—二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g.cm-3- | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
【1】在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是______;(填正确选项前的字母)
a 引发反应 b 加快反应速度 c 防止乙醇挥发 d 减少副产物乙醚生成
【2】装置B的作用_____________。
【3】在装置C中应加入______,其目的是吸收反应中可能生成的酸性气体;(填正确选项前的字母)
a 水 b 浓硫酸 c 氢氧化钾溶液 d 饱和碳酸氢钠溶液
【4】判断该制备反应已经结束的最简单方法是___________;将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在______层(填“上”、“下”);
【5】若产物中有少量未反应的Br2,最好用________洗涤除去;若产物中有少量副产物乙醚,可用____的方法除去;
【6】反应过程中应用冷水冷却装置D,其主要目的是_______;
【7】但又不能过度冷却(如用冰水),其原因是_______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙两种有机物(结构简式如下图),下列说法不正确的是
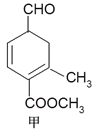
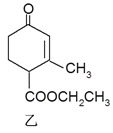
A. 二者与溴的CCl4溶液发生加成反应,消耗溴的物质的量分别为2mol、1mol
B. 甲、乙互为同分异构体
C. 1mol甲与H2在一定条件下反应,最多消耗3mol H2
D. 等物质的量的甲、乙分别与NaOH溶液反应,消耗NaOH的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用海水可以提取溴和镁,提取过程如下:

(1)提取溴的过程中,经过2次Br-→Br2转化的目的是_______,吸收塔中发生反应的离子方程式是SO2+Br2+2H2O=4H++2Br-+SO42-,蒸馏塔中发生反应的离子方程式是_____。
(2)从MgCl2溶液中得到MgCl26H2O晶体的主要操作是_________、冷却结晶、过滤、洗涤、干燥。由无水氯化镁得到镁的化学方程式是___。
(3)海水提取镁要用到海滩上的贝壳,贝壳的作用是:_______,贝壳经历变化的化学方程式为:____,CaO+H2O = Ca(OH)2
(4)六水合氯化镁脱水变成无水氯化镁的工艺条件是:____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验室需要 1.0 mol/L 的碳酸钠溶液 450 mL,利用碳酸钠晶体(Na2CO3·10H2O)来配制。下列说法正确的是
A. 应称取该碳酸钠晶体128.7 g
B. 取 100 mL 该溶液,向其中加入100 mL 水,所得溶液浓度为0.5 mol/L
C. 定容时俯视刻度线会引起配制溶液的浓度偏高
D. 定容、摇匀、静置后发现液面低于刻度线,应再补加少量水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把3.06 g铝和镁的混合物粉末放入100 mL盐酸中,恰好完全反应,并得到标准状况下3.36 LH2 计算:(要有过程)
(1)该合金中铝的物质的量_____。
(2)反应后溶液中Cl﹣的物质的量浓度(假定反应体积仍为100 mL)____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组在实验室研究SO2与Ba(NO3)2溶液的反应:
实验:向盛有2mL0.1mol/LBa(NO3)2溶液的试管中,缓慢通入SO2气体,试管内有白色沉淀产生,液面上方略显浅棕色。
探究1:白色沉淀产生的原因。
(1)白色沉淀是___。
(2)分析白色沉淀产生的原因,甲同学认为是NO3-氧化了SO2,乙同学认为是溶液中溶解的O2氧化了SO2。
①支持甲同学观点的实验证据是_____________________________________。
②依据甲的推断,请写出Ba(NO3)2溶液与SO2反应的离子方程式___________________________________。
③乙同学通过下列实验证明了自己的推测正确,请完成实验方案:
实验操作 | 实验现象 |
向2mL____mol/L____溶液(填化学式)中通入SO2 | ____________ |
探究2:在氧化SO2的过程中,NO3-和O2哪种微粒起了主要作用。
实验操作 | 实验数据 |
向烧杯中加入煮沸了的0.1mol/L的BaCl2溶液25mL,再加入25mL植物油,冷却至室温,通入SO2,用pH传感器测定溶液pH随时间(t)的变化曲线 |
图1:向BaCl2(无氧)溶液中通入SO2 |
向烧杯中分别加入25mL0.1mol/L的BaCl2溶液、Ba(NO3)2溶液,通入SO2,用pH传感器分别测定溶液pH随时间(t)变化的曲线。 |
图2:分别向BaCl2、Ba(NO3)2溶液中通入SO2 |
(3)图1,在无氧条件下,BaCl2溶液pH下降的原因是______________________________。
(4)图2,BaCl2溶液中发生反应的离子方程式为_________。
(5)依据上述图像你得出的结论是________,说明理由_________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com