
| A. | 0.5s | B. | 1s | C. | 30s | D. | 60s |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
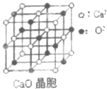 可以由下列反应合成三聚氰胺:CaO+3C$\frac{\underline{\;高温\;}}{\;}$CaC2+CO↑,CaC2+N2$\frac{\underline{\;高温\;}}{\;}$CaCN2+C,
可以由下列反应合成三聚氰胺:CaO+3C$\frac{\underline{\;高温\;}}{\;}$CaC2+CO↑,CaC2+N2$\frac{\underline{\;高温\;}}{\;}$CaCN2+C,查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向AlCl3溶液中逐渐滴入NaOH溶液至过量:Al3++3OH-═Al(OH)3↓ | |
| B. | 向NaOH溶液中逐渐滴入AlCl3溶液至过量:Al3++4OH-═AlO2-+2H2O | |
| C. | 在氨水中加入几滴硝酸铁溶液:Fe3++3OH-═Fe(OH)3↓ | |
| D. | 向Na2CO3溶液中滴加几滴稀盐酸:CO32-+H+═HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作和现象 | 结论 | |
| A | 向NaCl溶液中先滴加少量AgNO3溶液,后滴加少量NaI溶液,先有白色沉淀,后变成黄色沉淀 | 说明Ksp(AgI)<Ksp(AgCl) |
| B | 将SO2通入酸性KMnO4溶液中,紫色褪去 | 说明SO2具有漂白性 |
| C | 向FeCl3和CuCl2混合溶液中加入铁粉,有红色固体析出 | 说明氧化性:Cu2+>Fe3+ |
| D | 向某溶液中先滴加硝酸酸化,再滴加BaCl2溶液,有白色沉淀生成 | 该溶液中一定含有Ag+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知难溶性物质K2SO4•MgSO4•2CaSO4在水中存在如下平衡:K2SO4•MgSO4•2CaSO4(s)═2Ca2++2K++Mg2++4SO42-,不同温度下,K+的浸出浓度与溶浸时间的关系如图所示,则下列说法错误的是( )
已知难溶性物质K2SO4•MgSO4•2CaSO4在水中存在如下平衡:K2SO4•MgSO4•2CaSO4(s)═2Ca2++2K++Mg2++4SO42-,不同温度下,K+的浸出浓度与溶浸时间的关系如图所示,则下列说法错误的是( )| A. | 向该体系中加入饱和NaOH溶液,溶解平衡向右移动 | |
| B. | 向该体系中加入饱和碳酸钠溶液,溶解平衡向右移动 | |
| C. | 该平衡的Ksp=c(Ca2+)•c(K+)•c(Mg2+)•c(SO42-) | |
| D. | 升高温度,反应速率增大,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com