
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
 .
.分析 由元素在周期表中的位置可知,①为N,②为F,③为Na,④为Mg,⑤为Al,⑥为Si,⑦为Cl,⑧为Ar,⑨为K,⑩为Br.
解答 解:由元素在周期表中的位置可知,①为N,②为F,③为Na,④为Mg,⑤为Al,⑥为Si,⑦为Cl,⑧为Ar,⑨为K,⑩为Br.
(1)稀有气体Kr的化学性质最不活泼,其原子核外有18个电子,各层电子数为2、8、8,其原子结构示意图为: ,
,
故答案为: ;
;
(2)上述元素中除F(F没有正价)外Cl的非金属性最强,则最高价氧化物对应的水化物的酸性最强,该酸为HClO4,K的金属性最强,则KOH的碱性最强,故答案为:HClO4;KOH;
(3)铝可以和氢氧化钠之间反应生成偏铝酸钠和氢气:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,Al的氢氧化物与氢氧化钠溶液反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;Al(OH)3+OH-=AlO2-+2H2O;
(4)将Cl2通入③与⑩组成的化合物溴化钠中,氯气具有氧化性,能将溴离子氧化为溴单质,发生反应的离子方程为:Cl2+2Br-=2Cl-+Br2,故答案为:Cl2+2Br-=2Cl-+Br2;
(5)氮气可以和氢气合成氨,氨气是一种碱性气体,催化氧化得到一氧化氮是制取硝酸获得一氧化氮的重要一步,反应为:4NH3+5O2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$4NO+6H2O,故答案为:4NH3+5O2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$4NO+6H2O.
点评 本题考查位置结构性质的应用,需要学生熟悉元素在周期表中的结构,注意掌握物质的性质以及离子方程式的书写是关键.


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:解答题
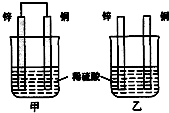 (1)已知:△H>0为吸热反应、△H<0为放热反应.实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是C.
(1)已知:△H>0为吸热反应、△H<0为放热反应.实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是C.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 头孢羟氨苄(如图)被人体吸收效果良好,疗效明显,且毒性反应较小,因而被广泛适用于敏感细菌所致的多种疾病治疗.下列对头孢羟氨苄的说法中正确的是( )
头孢羟氨苄(如图)被人体吸收效果良好,疗效明显,且毒性反应较小,因而被广泛适用于敏感细菌所致的多种疾病治疗.下列对头孢羟氨苄的说法中正确的是( )| A. | 头孢羟氨苄可与NaOH溶液反应但不与HCl反应 | |
| B. | 该化合物中含有4个手性碳原子 | |
| C. | 在催化剂存在条件下,1mol头孢羟氨苄可与7molH2发生反应 | |
| D. | 头孢羟氨苄不能在空气中稳定存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气体的分子大小不同 | B. | 气体分子间的平均距离不同 | ||
| C. | 气体的性质不同 | D. | 气体的物质的量不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
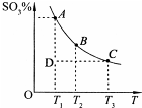 硫酸的年产量可以用来衡量一个国家的化工生产能力.工业生产硫酸的流程中存在反应:2SO2(g)+O2(g)?2SO3(g).反应体系中SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题:
硫酸的年产量可以用来衡量一个国家的化工生产能力.工业生产硫酸的流程中存在反应:2SO2(g)+O2(g)?2SO3(g).反应体系中SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题:
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | C4H6 C3H8 | B. | C5H10 C6H6 | C. | C2H6O C2H4O2 | D. | C3H6 C3H8O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5s | B. | 1s | C. | 30s | D. | 60s |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 参加反应的硝酸的物质的量为0.4mol | |
| B. | 加入合金的质量可能为9.6g | |
| C. | 沉淀完全时消耗NaOH溶液体积为150mL | |
| D. | 溶解合金时产生NO气体体积0.224L(以标准状况) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com