
【题目】化合物![]() (甲)、
(甲)、 (乙)、
(乙)、 (丙)的分子式均为C8H8,下列说法不正确的是
(丙)的分子式均为C8H8,下列说法不正确的是
A. 甲、乙、丙在空气口燃烧时均产生明亮并带有浓烟的火焰
B. 甲、乙、丙中只有甲的所有原子可能处于同一平面
C. 等量的甲和乙分别与足量的溴水反应,消耗Br2的量:甲>乙
D. 甲、乙、丙的二氯代物数目最少的是丙
【答案】C
【解析】分析:本题考查烃的分子结构和性质,涉及燃烧、原子共面问题、反应物耗量多少的分析和同分异构体的判断。
详解:A. 甲、乙、丙分子式均为C8H8,含碳量高,燃烧时均产生明亮并带有浓烟的火焰,故A正确;B.甲烷是正四面体结构,乙、丙中含有类似于甲烷饱和碳原子,所有原子不可能处于同一平面,甲中含有苯环和碳碳双键,由于连接的碳碳单键可以旋转,两个平面可以重合,所以只有甲的所有原子可能处于同一平面,B正确;C.苯环不和溴水反应,甲和乙与溴水反应是碳碳双键上的加成反应,由于乙中含有3个碳碳双键,所以消耗Br2的量:甲<乙,C错误;D. 由于丙的对称性最好,故二氯代物数目最少的是丙,只有三种,故D错误;综合以上分析,本题答案为C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】我国科研人员研制出一种室温“可呼吸”Na-CO2电池。放电时该电池“吸入”CO2,充电时“呼出”CO2。吸入CO2时,其工作原理如右图所示。吸收的全部CO2中,有![]() 转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面。下列说法正确的是( )
转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面。下列说法正确的是( )

A. “吸入”CO2时,钠箔为正极
B. “吸入”CO2时的正极反应:4Na++ 3CO2+ 4e-= 2Na2CO3+ C
C. “呼出”CO2时,Na+向多壁碳纳米管电极移动
D. 标准状况下,每“呼出”22.4 L CO2,转移电子数为0.75 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的Mg和Al混合物投入到200mL稀硫酸中,固体全部溶解后,向所得溶液中滴加NaOH溶液至过量,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。则下列说法不正确的是

A. Mg和Al的总质量为9g
B. 最初20mLNaOH溶液用于中和过量的稀硫酸
C. NaOH溶液物质的量浓度为5mol·L-1
D. 生成的氢气在标准状况下的体积为11.2L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂和氮的相关化合物在化工、医药、材料等领域有着广泛的应用。请回答下列问题
(1)Li的氢标电势是最负的,达到-3.045V,与水有很大的反应倾向,然而将Li单质加入水中,其反应烈程度远不如其他碱金属,试解释原因__________。
(2)基态氮原子中,核外电子占据的最高能层的符号为_______,核外电子能量最高的电子的电子云轮廓图形状为_________。
(3)氮元素既可与其他元素形成正离子,比如N2O5结构中存在NO2+的结构,其空间构型为__________,氮原子的杂化形式为____________;它也可以形成全氮的正离子,比如N5AsF6中存在高能量的N5+,N5+的空间构型为_______。(每个N原子都满足8电子稳定结构)
(4)下图为一种N和Li形成的二元化合物的晶体结构,试在图中画出其晶胞_____,并写出该化合物的化学式_________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】300 mL某浓度的NaOH溶液中含有60 g溶质。现欲配制1 mol /L NaOH溶液,应取原溶液与蒸馏水的体积比约为( )
A. 1∶4 B. 1∶5 C. 2∶1 D. 2∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以CH4为原料制备H2的原理为CH4(g)+H2O(g)![]() CO(g)+3H2(g)。在一定条件下向a、b两个恒温恒容的密闭容器中均通入1.1molCH4(g)和1.1molH2O(g),测得两容器中CO的物质的量随时间的变化曲线分别为a和b。已知容器a的体积为10L,温度为Ta,下列说法不正确的是
CO(g)+3H2(g)。在一定条件下向a、b两个恒温恒容的密闭容器中均通入1.1molCH4(g)和1.1molH2O(g),测得两容器中CO的物质的量随时间的变化曲线分别为a和b。已知容器a的体积为10L,温度为Ta,下列说法不正确的是
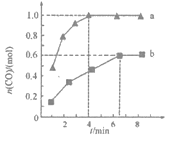
A. 容器a中CH4从反应开始到怡好平衡时的平均反应速率为0.025mol·L-1·min-1
B. a、b两容器的温度可能相同
C. 在达到平衡前,容器a的压强逐渐增大
D. 该反应在Ta温度下的平衡常数为27(mol·L-1)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学-选修3:物质结构与性质]固体电解质有广泛的用途。研究发现,晶体中有特殊结构为离子(如Li+)提供快速迁移的通道或者有“点缺陷”。都能使其具有导电潜力,比如:图(a)所示的锂超离子导体Li3SBF4和图(b)所示的有“点缺陷”的NaCl。
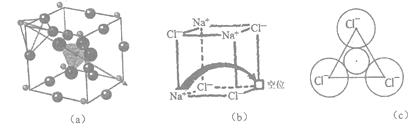
根据所学知识回答下列问题:
(1)在变化“Cl+e-→Cl-”过程中,所得电子填充在基态 Cl的________能级,此过程会________ (填“吸收”或“释放”)能量。
(2)BF4-中B的杂化形式为________________,其等电子体为___________(任写一种)。与其VSEPR模型相同,且有l对孤电子对的相对分子质量最小的分子是___________。
(3)图(a)所示晶胞中Li+位于_____位置;若将晶体中BF4-换成F-,导电能力会明显降低,原因是______________________________。
(4)图(6)中,若缺陷处填充了Na+,则它__________(填“是”或“不是”) NaCl的晶胞,在NaCl晶体中,Na+填充在Cl-堆积而成的__________面体空隙中。
(5)有人认为:高温下有“点缺陷”的NaCl晶伙导电性增照是由于Na+迁移到另一空位而造成。其中Na+经过一个由3个Cl-组成的最小三角形窗孔(如图c所示)。已知晶胞参数a=564 pm,r(Na+)=116pm, r(Cl-)=167 pm,通过计算三角形窗孔半径,判断该认识是否正确。__________。(已知:![]() ≈1.414,
≈1.414,![]() ≈1.732)
≈1.732)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com