
| A. | 苯酚是一种弱酸,滴加指示剂不变色 | |
| B. | 其浓溶液对皮肤有强烈的腐蚀性,如果不慎沾在皮肤上,应立即用酒精擦洗 | |
| C. | 碳酸氢钠溶液中滴入苯酚的水溶液后会放出二氧化碳 | |
| D. | 其在水中的溶解度随温度的升高而增大,超过65℃可以与水以任意比互溶 |
分析 苯酚为弱酸,酸性比碳酸还弱,滴加指示剂不变色,具有腐蚀性,易溶于酒精,微溶于水,在水中的溶解度随温度的升高而增大,超过65℃可以与水以任意比互溶,以此解答该题.
解答 解:A.苯酚酸性较弱,电离程度小,与酸碱指示剂不发生颜色反应,故A正确;
B.苯酚有毒,不溶于冷水,易溶于酒精,若其浓溶液不慎沾在皮肤上,应立即用酒精擦洗,故B正确;
C.由于苯酚酸性小于碳酸酸性,在碳酸氢钠溶液中滴入苯酚的水溶液,不会生成二氧化碳气体,故C错误;
D.常温下苯酚难溶于水,但苯酚在水中的溶解度随温度的升高而增大,当超过65℃可以与水以任意比互溶,故D正确.
故选C.
点评 本题考查学生苯酚的性质,题目难度不大,注意掌握苯酚的性质及其应用,明确苯酚与碳酸、碳酸氢根离子的酸性强弱,试题侧重基础知识的考查,培养了学生灵活应用基础知识的能力.


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案 期末好成绩系列答案
期末好成绩系列答案科目:高中化学 来源: 题型:选择题
| A. | X可用新制的氢氧化铜检验 | B. | Y有同分异构体 | ||
| C. | M含有两种碳氧共价键 | D. | Y可发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物.
溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解MgCl2饱和溶液,可制得金属镁 | |
| B. | 采用牺牲阳极的阴极保护法:在海轮外壳连接锌块保护外壳 | |
| C. | 金属在潮湿空气中腐蚀的实质是:M+nH2O═M(OH)n+$\frac{n}{2}$ H2↑ | |
| D. | 地下钢管与外加直流电源的正极相连以保护它不受腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚俗称石炭酸,酸性比碳酸强 | |
| B. | 皮肤上若沾有少量苯酚,正确的处理方法是用70℃热水洗 | |
| C. | 实验室做钠与乙醇的实验时,余下的钠屑投入到废液缸中 | |
| D. | 乙醇熔沸点比含相同碳原子的烷烃熔沸点高的主要原因是乙醇分子之间易形成氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所得的分散系可用过滤的方法进行提纯 | |
| B. | 所得的分散系中分散质为Fe2O3 | |
| C. | 当一束强光通过该分散系时会出现光亮的通路 | |
| D. | 该分散系不稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
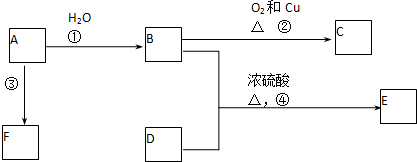

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ${\;}_{1}^{2}$H | 2He | 2Cl | Ba2+ | |
| A | 质量数 | 中子数 | 质子数 | 电荷数 |
| B | 质量数 | 质子数 | 原子个数 | 电荷数 |
| C | 质子数 | 中子数 | 原子个数 | 电荷数 |
| D | 质量数 | 质子数 | 中子数 | 电荷数 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有A、B、C、D四种短周期元素,其中A元素和B元素的原子都有1个未成对电子,A+ 比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p 轨道中有3个未成对电子,其气态氢化物的水溶性在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4.请问答下列问题:
有A、B、C、D四种短周期元素,其中A元素和B元素的原子都有1个未成对电子,A+ 比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p 轨道中有3个未成对电子,其气态氢化物的水溶性在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4.请问答下列问题: ,CB3分子的VSEPR模型为四面体形.
,CB3分子的VSEPR模型为四面体形.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com