
甲、乙两物质的溶解度曲线如图所示。下列叙述中,正确的是( )
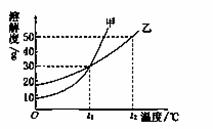
A. t1 ℃时,在100 g水中放入60 g甲,其溶质的质量分数为37.5%
B.t1 ℃时,甲和乙的饱和溶液的物质的量浓度一定相等
C.t2 ℃时,甲和乙的饱和溶液中溶质的质量分数一定相等
D.t2 ℃时,分别在100 g水中各溶解20 g甲、乙,同时降低温度,甲先达到饱和
科目:高中化学 来源: 题型:
氮化钠和氢化钠都是离子化合物,与水反应的方程式(未配平)如下:
Na3N+H2O→NaOH+NH3,NaH+H2O→NaOH+H2。有关它们的叙述①离子半径:Na+>N3->H+;②与水的反应都是氧化还原反应;③与水反应后的溶液都显碱性;④与盐酸反应都只生成一种盐;⑤两种化合物中的阴阳离子均具有相同的电子层结构。其中正确的是
A.②③④⑤ B.①③⑤ C.②④ D.③
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.常温常压下,32 g O2和O3的混合气体所含原子数为2NA
B.100 mL 1 mol·L-1 K2SO4溶液 中含有的钾离子数为0.1NA
中含有的钾离子数为0.1NA
C.10克氖气所含原子数约为6.02×1023
D.常温常压下,NA个H2分子的体积小于22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
某校化学研究性学习小组设计如下实验方案,测定放置已久的小苏打样品中纯碱的质量分数。
(1)方案一:称取一定质量的样品,置于坩埚中加热至恒重后,冷却,称量剩余固体质量,计算。实验中加热至恒重的目的是__________________________________________。
(2)方案二:按如图所示装置进行实验。并回答以下问题:
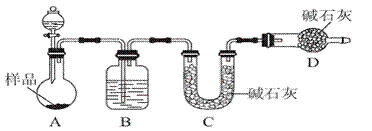
①实验前应先______________________________________________。
分液漏斗中应该装________(填“盐酸”或“稀硫酸”)。D装置的作用是_____________________________________________________________________;
②实验中除称量样品质量外,还需称________装置(用字母表示)前后质量的变化;
③根据此实验得到的数据,测定结果有较大误差。因为实验装置还存在一个明显缺陷,该缺陷是 。
(3)方案三:称取一定量样品,置于小烧杯中,加适量水溶解,向小烧杯中加入足量氯化钡溶液,过滤洗涤,干燥沉淀,称量固体质量,计算:
①过滤操作中,除了烧杯、漏斗外还用到的玻璃仪器有_________________________;
②实验中判断沉淀是否完全的方法是_________________________________________;
③若加入试剂改为氢氧化钡,已知称得样品9.5 g,干燥的沉淀质量为19.7 g,则样品 中碳酸钠的质量分数为 (保留一位小数)。
中碳酸钠的质量分数为 (保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中不正确的是( )
A.HCl的相对分子质量与6.02×1023个HCl分子的质量(以g为单位)在数值上相等
B.6.02×1023个氮分子和6.02×1023个氢分子的质量比等于14∶1
C.32 g氧气所含的原子数目为2×6.02×1023
D.常温常压下,0.5×6.02×1023个一氧化碳分子所占体积是11.2 L
查看答案和解析>>
科目:高中化学 来源: 题型:
已知在25℃时:2C(s)+O2(g)=2CO(g) △H1=-222kJ/mol
2H2(g)+O2(g)=2H2O(g) △H2=-484kJ/mol
C(s)+O2(g)=CO2(g) △H3=-394kJ/mol
则25℃时,CO(g)+H2O(g)=CO2(g)+H2(g)的反应热△H4为( )
A.-82kJ/mol B.-41kJ/mol C.-312kJ/mol D.+82kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机物的结构为下图所示,这种有机物不可能具有的性质是( )
①可以燃烧; ②能使酸性KMnO4溶液褪色;
③能跟NaOH溶液反应; ④能发生酯化反应;
⑤能发生加聚反应; ⑥能发生水解反应
A.①④ B.只有⑥ C.只有⑤ D.④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)淀粉的化学式是 ;玻璃、陶瓷、水泥一定含 元素。造成赤潮的主要元素
是 ;油脂在体内水解后的产物是 和高级脂肪酸。
(2)常见的塑料有两类,一类是 塑料,如聚乙烯,一类是 塑料,如酚醛树脂等。
硫化后的橡胶适合制造汽车轮胎,加入 可增强轮胎的耐磨性。
(3)在“棉花、尼龙、黏胶纤维、蚕丝”这四中纤维中,属于天然纤维的是 ;属于
人造纤维的是 ;属于合成纤维的是 。
(4)药品标签上应贴有 “OTC”或“R”符号,①“OTC”它表示 ,②“R”表示 ,
氢氧化铝和碳酸氢钠都可用作抗胃酸药。写出:
③氢氧化铝与胃酸作用的离子方程式: ;
④碳酸氢钠与胃酸作用的化学方程式: 。
(5)一个体重50kg的健康人,体内约含有2g铁,这2g铁在人体内不是以单质的形式存在,而
是以Fe2+ 和Fe3+的形式存在。正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+
的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体吸收。
①往KMnO4溶液中滴入维生素C溶液,KMnO4溶液褪色说明维生素C具有 性,
②人体长期缺乏维生素C会引起 病,
③市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸的作用下
转化成亚铁盐。此反应的离子方程式为
(6)我国城市为了减少燃煤造成的大气污染,对民用燃料的煤作了多方面的改进。
①绿色能源是人类的理想能源不会造成环境污染,下列能源不属于绿色能源的是
A.氢能源 B.太阳能 C.风能 D.石油
②为了除去煤中的含硫化合物,采用FeCl3脱硫,即用FeCl3溶液浸洗煤粉,发生如下反
应:FeS2+14FeCl3+8H2O===2FeSO4+13FeCl2+16HCl 该反应中的氧化剂是 ;
为了充分利用Fe2+并减少酸(HCl)污染,本方法中可利用工业废铁屑和氯气让废液重新
利用生成FeCl3。请写出这一过程中有关的离子方程式:
、 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com